設計開発計画書 ㈱イーコンプライアンス
設計開発計画書
設計開発計画書は、設計が適切に管理されているかどうかを示す重要な文書である。
計画書には、設計の各フェーズを誰が主導し、責任を負うかを記載すること。
設計のアプローチは、非常に複雑で多くのチームメンバーが関わるため、計画の様々なステージで責任を明確に定義することは非常に重要である。
例えば、品質保証グループまたはプロジェクトマネジメントグループがデザインレビュを主導するが、R&D、臨床、薬事、品質技術、製造およびマーケティングの全てのチームメンバーが、必要に応じて関わるべきである。
インターフェースの特定には、設計プロセスに関わる組織グループ(例、マーケティング、購買、品質保証、製造およびサービス)の役割の定義および彼らに転送され、受領される情報の記載が含まれる。
これは、複数の組織や外部の会社または契約者が関わる場合には、特に重要である。
必要に応じてフローチャートを作成し、インターフェースを特定すること。
設計開発計画は設計プロセスが適切にコントロールされ、機器の品質目標を満たしていることを保証するために必要である。計画は設計管理要求に沿っていなければならない。
一般的に設計開発計画で述べられる要素を次に掲げる。
- 設計開発プログラムについての目標および対象の記述
- 設計開発フェーズにおける、品質保証の観点での組織責任図。契約業者との関係も含めること。
- 実施する主要なタスク、各タスクの成果物、各タスクを遂行するための個人または組織的責任(スタッフおよびリソース)の特定
- プログラム全体の時間制約を満たす、主要なタスクのスケジューリング
- レビュワーの選定、レビュチームの構成、レビュワーが従うべき手順
- 設計文書の管理
- 周知活動
設計開発計画書のレビュ・承認と更新
設計開発計画書をレビュし、承認したことを証明すること。
設計開発計画書は、設計および開発プログラムが進展する毎に適切に更新し、レビュ、承認すること。(変更管理を適切に行うこと)
レビュおよび計画書更新の頻度は、計画書内に記載すること。
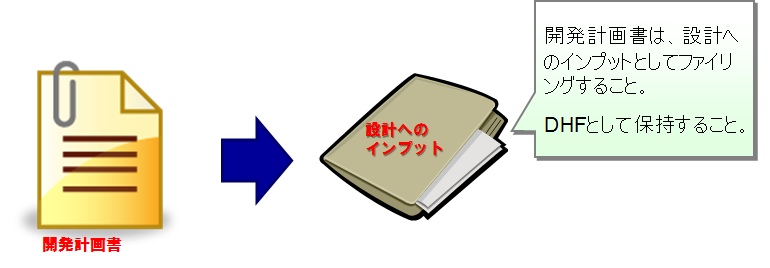
設計開発計画書はDHFへ
設計開発計画書は、設計へのインプットの1つである。
計画書は、承認バージョン毎に、DHFとして保持すること 。
設計開発計画書の内容
設計開発計画書作成のための手順書を作成し、以下を記載すること。
- 設計開発プログラムの達成目標と目的
- 要員計画
組織の責任の定義
設計開発業務の責任者、リーダー、担当者等(資格の特定)
適切なスキルをもった要員(内部および委託契約者やコンサルタント)
誰がどの段階でデザインレビュ・検証・バリデーションに関わるのかの定義
設計開発に携わる関連部門の責任者
各部門間のインターフェース - 設計開発のスケジュール(製品開発のライフサイクル全体)
主要なタスクのマイルストーン
主要なデザインレビュおよび設計ポイントの特定
検証・バリデーションのタイミング - 品質システムに従った設計の各フェーズに必要な要素
- 成果物
各タスクの成果物および担当者・関係者の責任の特定
どのレベルの詳細さがレビュおよび承認に必要かの明確な説明 - リスク管理計画
ISO14971にもとづいたリスク管理
リスク分析を実施するフェーズ
リスク分析をいつどのようにして実施するか - デザインレビュ・検証・バリデーション
評価項目、評価基準
- 文書管理
- 進捗管理
執行責務を負うマネジメントおよびチームメンバーがプロジェクトの進捗を知る方法
ガントチャート
- 参考
21 CFR Part820 Quality System Regulation, FDA 1997
Design Control Guidance For Medical Device Manufacturers, FDA 11 March,1997
FDA査察対応設計管理手順書サンプル
イーコンプライアンスでは、FDAが要求する設計管理に対応した、規程、手順書、様式のサンプルを販売しています。
ぜひご購入をご検討下さい。
【関連記事】
★ リスクマネジメント
★ CAPA
★ 21 CFR Part 11
★ FDA関連情報
★ CSV関連情報
★ Part11関連情報
★ ER/ES指針関連情報
★ EDC関連情報
★ ドキュメント管理システム導入の考え方
用語集






