CSVと適格性評価とプロセスバリデーションの関係 ㈱イーコンプライアンス
CSVと適格性評価とプロセスバリデーションの関係
「ハード」と「ソフト」 は、GMPを語る上でははずせない要素・考え方である。
GMPハードとGMPソフトの両面で、GMPの3つの原則を達成する。

GMPハード
- ハードとは、製造施設・設備・機器等のこと
- 間違いを防ぐことのできる設備・環境の製造所であること
- 衛生的な設備・環境の製造所であること
- 高い品質を保ち続けることができる設備・環境の製造所であること
GMPソフト
- ルールを決めて文書化すること
- ルールどおりに実施し、記録を作成すること
- 定期的に見直しを行い、改善をはかること
GMPハードは主にハードウェアからできている。
しかしながら昨今では多くの構造設備はハードウェアを比較的小さなプログラム(PLC、ファームウェア。以下、ソフトウェア)によって制御していることが多い。
ソフトウェアで制御されているGMPハードのことをコンピュータ化システムと呼ぶ。
コンピュータ化システムで重要なことは、手作業で実施していた作業を、ソフトウェアが制御するようになっても、製造される(分析される)医薬品の品質や品質保証が劣化してはならないということである。
そのために、ソフトウェアのバリデーション(CSV:Computerised System Validation)を実施する必要がある。
つまりCSVのゴールは、手作業とコンピュータ制御で製造される製品の同等の品質と品質保証を担保することである。
またコンピュータ化(自動化)することによってリスクが増大してもいけない。
コンピュータ化されていようがいまいが、GMPハードは使用前に適格性評価(Qualification:DQ、IQ、OQ、PQ)を実施しなければならない。
つまりGMPハードに対するバリデーションのことを適格性評価(Qualification)と呼ぶ。
適格性評価は、設備等を導入した際に1度だけ実施する 。
なお、CSVは単独で実施することはできない。
なぜならばハードウェアを制御しているためである。
したがって、CSVは設備の適格性評価(Qualification)の一部として実施するのである。
つまり、適格性評価報告書の1つの章がCSVに相当する。
適格性評価を実施したGMPハードを用いて、GMPソフトと共にプロセスバリデーションを実施することになる。
プロセスバリデーションは、品目ごとに実施しなければならない。
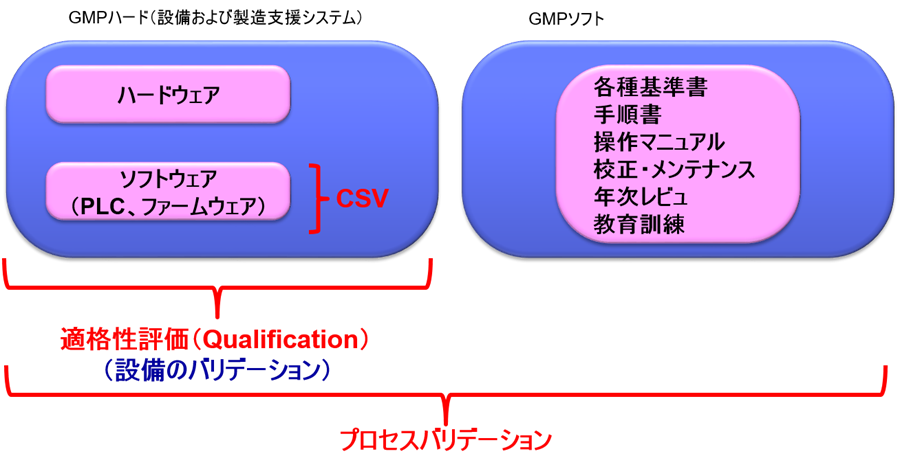
つまりプロセスバリデーションはGMPソフトとGMPハードの両方を含み、GMPハードに関するバリデーションはQualification(適格性評価)を行うことである。
CSV、適格性評価(Qualification)、プロセスバリデーションの関係を説明しているセミナーや書籍は皆目ない。
製薬企業を混乱させている所以である。

