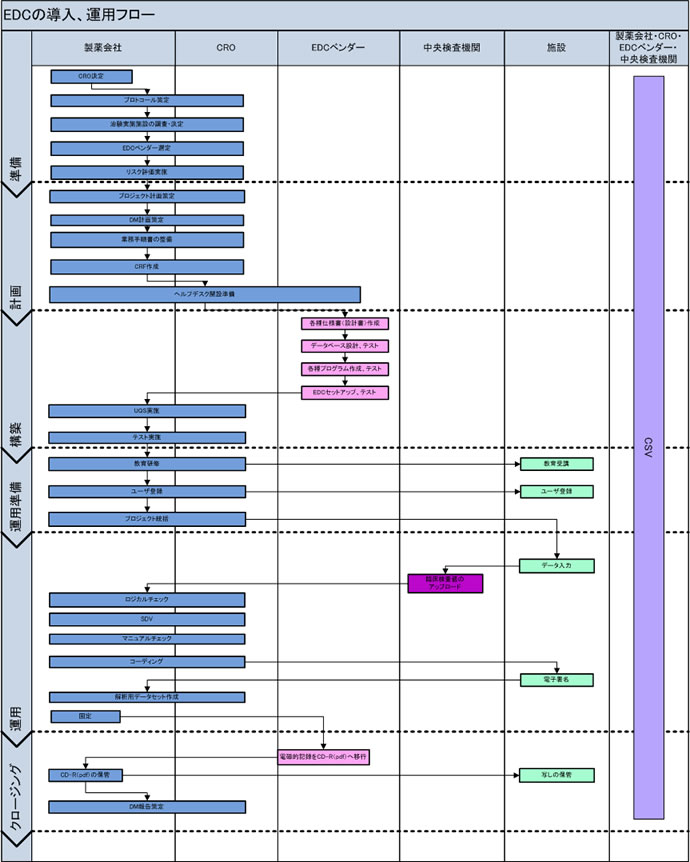
EDCとは
これまで製薬会社は、臨床試験において「紙」の症例報告書(以下、紙CRF)を用いて症例データを取得していましたが、最近では電子的にデータを取得するElectronic Data Captureシステム(以下、EDC)が注目されるようになってきました。
医療機関にあるパソコンまたは 配布したパソコンで 治験責任医師、治験分担医師、 治験スタッフなどが臨床データつまり症例報告書の内容などを入力し、 そのデータを インターネットあるいは専用回線経由で、電子的にサーバに取り込む形態のことです。
EDCでは、入力時のデータチェックや、 欠損チェック、整合性チェックをはじめ、ロジカルチェック、コーディングなどのデータマネージメント機能を持っているものがあります。
EDCを利用すれば、もはやCDMS(Clinical Data Management System)は不要になることが予想されます。
EDCからSASなどの統計解析システムへ、データを直接渡すことができれば良いわけです。
EDCは通常ASP(Application Sevice Provider)契約で使用されるのが一般的です。医療機関からインターネットなどのネットワークを介して、ASP契約をしたデータセンター上のEDCサーバに症例データを入力します。
製薬会社も、インターネットなどを介して、ASPプロバイダの運営するEDCサーバに接続して、症例データの確認などを行います。
モニターは、これまでのように医療機関に行かなくとも、治験の進捗管理を行うことができます。
またクエリ機能を使用すれば、EDCシステムから、治験責任医師等に対して、クエリを発行することができます。治験責任医師等は、クエリをEDCシステムの画面上で確認し、必要に応じてデータの修正と、クエリへの回答を行います。
モニターと治験責任医師等が、同じ画面を見ながら、電話で相談することもでき、コミュニケーションツールとしても有効です。
治験が終了した場合、ASP契約が終了しますので、症例データをCD-Rなどの電子媒体にコピーしてもらいます。

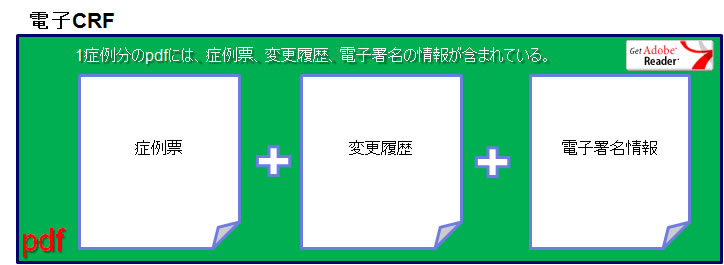
この際に、pdf形式で出力するのが一般的です。pdfファイルは、1症例あたり1ファイルであり、症例データに加えて、変更履歴(監査証跡)、電子署名情報が一緒に記録されています。これを電子CRF(eCRF)と呼びます。
ある著名なEDCシステムでは、ユーザを無効化した際に監査証跡が消去されてしまうという、非常に大きな欠陥があります。
セキュリティ上、LPO(Last Patient Out:最終症例終了)の際や、治験責任医師等の異動の際には、当該医療機関のユーザを無効化しなければなりません。その際には、無効化するのではなく、パスワードを変更するといった代替手段が望まれます。