監査員認定支援サービスについて ㈱イーコンプライアンス
監査員認定支援サービスについて
監査の目的
1. 自社のQMSが規制要件(レギュレーション)に適合していること。
2. QMSが有効であること。(品質が向上する保証があること)
監査はなぜ必要か
- 人が作るものに全てが完全なものはない(必ず不完全な部分を含む)。
- 自分ではみつけられない部分がある。
- 人には弱い所があり、出来心も含めてよこしまな考えが頭をもたげることがある。
監査は第三者的に確認する作業であり品質保証に必須項目。
- 監査は欠陥をみつけるのが仕事ではない。
- 欠陥がないことを確認するのが本来の業務である。
- 万が一欠陥がみつかればそれを指摘する。
- よこしまな考えに対しては抑止力の発現と万が一の場合は毅然とした態度で臨む。
内部監査の重要性について
- 内部監査によって、以下を保証すること。
「自己点検」は、英語ではSelf Inspectionと呼んでいる。
- これまでの医療機器業界は、当局の指摘に従って改善していれば、許可が与えられた。
- しかしながら、当局の指摘を行う能力や、時間に依存する。
- 当局の査察(Authority Inspection)ではなく、自社の内部監査(Self Inspection)により、リスクを受容可能まで低減すること。
- 「自己点検」は、内部監査、外部監査、定期レビュ、マネージメントレビュなどからなる。
査察官の関心は、問題をどう解決したかではなく、残存するリスクがないかどうかである。
監査の結果は、責任ある経営者に適切に報告すること。
ISO9000 適合性と妥当性~文書と記録~

システム監査では、品質管理の仕組み(QMS)が法規制等(レギュレーション)に準拠していることを確認(適合性の確認)する。
プロセス監査では、適合性のあるQMSのもと、適切に品質管理システムが履行されていることを確認(妥当性の確認)する。
どんな企業が査察官に安心感を与えるか
- 査察官と同様のスキル・経験・洞察力をもった監査員が存在し、内部監査(Self Inspection)が適切に実施されている。
- 内部監査の指摘に対して、CAPAを実行し、常に改善を図っている。
- 品質システムが有効に機能しており、その証拠が揃っている。
「Self Inspection」について
- Self Inspectionは、日本の省令等では「自己点検」と訳されているが、この用語は適切ではない。
- Self Inspectionでは、潜在している問題点(つまりリスク)を自ら発見すること。
- Self Inspectionでは、企業自らの内部監査等によって、日々リスクを発見し、是正・予防することが重要である。
- つまり当局査察で指摘されるのを待って改善するのではなく、企業自らが積極的に改善活動を実施するのである。
- 是正処置・予防処置や内部監査の結果は、マネージメントプロセスにフィードバックし、マネジメント(経営者)が、マネジメントレビュなどによって改善指示を出したり、次年度の品質目標をたてることになる。
820.22 品質監査
§820.22 品質監査
各製造業者は、品質監査の手順を確立し、そのような監査を次の目的で行うこと。
すなわち品質システムが確立された品質システム要求事項に適合されていることを確実にするため、および品質システムの有効性を判定するためである。
品質監査は、監査される事項に直接の責任を持たない者によって実施されること。
不具合事項の再監査を含む是正処置を必要な場合、講じること。
毎回の品質監査の結果の報告、および再監査があれはその結果の報告書を作成し、そのような報告書は監査された事項に責任をもつ管理者によってレビュされること。
監査および再監査を行った日付および結果は文書化されること。
PDCAのサイクルと再発防止
- 企業のトップ以下が全員参加で、PDCAのサイクル(Plan・Do・Check・Action)を回し続け、企業全体がスパイラルアッフするシステムを構築すること。
- そのためには、内部監査と是正処置が企業の体質の強化にとってきわめて重要である。
- 企業体質を向上させるチャンスを自ら放棄するような原因究明の省略は厳に慎まなければならない。
- 同じ不適合が何度も繰り返して起きることがないような再発防止のシステム作りが大切である。
- 一概に単純な不適合だから単なる修正処置をするだけで良いとか、原因究明や再発防止をする必要がないと考えるのは企業のスパイラルアップのために得策ではない。
- 単純な不適合こそ、原因究明や再発防止を怠ると、モグラ叩きのようにまた同じ不適合が繰り返されてしまい、PDCAのサイクルが回らなくなってしまう。
品質システムとは

品質システムとは
1. マネージメントプロセスでは、経営者が品質方針を作成し、また年度毎に品質目標をたてる。
品質目標では、達成可能な目標であることと、具体的な数値とともにその達成基準が明確になっていなければ
ならない。例えば、顧客苦情を3ポイント減少させる、逸脱を5ポイント下げる、顧客満足度を10ポイント増加
させるなどである。
また、定期的にマネジメントレビュを実施し、品質改善に関する適切な指示を出さなければならない。
2. リソースプロセスでは、経営者は適切なリソース(人、モノ、金)をあてがわなければならない。口頭で指示
するだけでリソースを準備しなければ、品質改善が実行できないからである。例えば、要員を雇用する、教育
訓練を実施する、コンサルタントを雇うなどである。
3. 開発・生産プロセスでは、QMSに従って、研究・開発・設計・製造・流通・サービス等を実施する。
その目的は、ユーザニーズ(要求)に合致した製品を市場に出荷し、顧客満足度を得ることである。
4. 有効性向上プロセスでは、顧客苦情などの収集を行い、再発防止に向けた是正処置・予防処置を行う。
是正処置で重要なことは、問題の根本的原因を調査し、それを解消することにより、再発を防止することであ
る。是正と修正は異なることに注意が必要である。
また内部監査を実施し、潜在している問題点(つまりリスク)を自ら発見することである。なお内部監査は
「Self Inspection」(自主的な査察)と呼ばれている。Self Inspectionは、日本の省令等では「自己点検」と
訳されているが、この用語は適切ではない。
Self Inspectionでは、企業自らの内部監査等によって、日々リスクを発見し、是正・予防することが重要であ
る。
つまり当局査察で指摘されるのを待って改善するのではなく、企業自らが積極的に改善活動を実施するのであ
る。
是正処置・予防処置や内部監査の結果は、マネージメントプロセスにフィードバックし、マネジメント(経営
者)が、マネジメントレビュなどによって改善指示を出したり、次年度の品質目標をたてることになる。
有効性向上プロセス
- Self Inspectionでは、潜在している問題点(つまりリスク)を自ら発見すること。
- Self Inspectionでは、企業自らの内部監査等によって、日々リスクを発見し、是正・予防することが重要である。
- つまり当局査察で指摘されるのを待って改善するのではなく、企業自らが積極的に改善活動を実施するのである。
- 是正処置・予防処置や内部監査の結果は、マネージメントプロセスにフィードバックし、マネジメント(経営者)が、マネジメントレビュなどによって改善指示を出したり、次年度の品質目標をたてることになる。

品質システムとは
こういった品質改善の仕組みを「品質システム(QS)」と呼ぶ。品質システム(QS)はPDCAが基本である。
品質システム(QS)が存在するということは、今日よりも明日、明日よりも明後日は品質が向上するといった保証が存在するということである。
なお、品質システムの仕組みをQuality Management System(QMS)と呼ぶ。
FDA等の査察では、企業自らが品質システム(QS)を確立しており、査察が実施されていなくとも査察官と同様の目線(レベル)で指摘・改善活動が実施されていることを確認するのである。
そのためには優秀な監査要員の確保が最重要である。
品質システム(QS)が確立されている企業は、査察官にとって「安心」できる企業であるといえる。

品質システム査察とは
医薬品企業・医療機器企業がグローバル化を促進する中、FDAをはじめ海外の規制当局の査察を受ける機会が多くなった。
一方で規制当局は、サプライチェーンがグローバル化していることに伴い、海外査察の回数を増やしている。
しかしながら、査察にかけることができるリソースは限られているため、効率的な査察手法が必要である。
従来の査察では、査察官から指摘された事項を是正しておけば、容認されてきた。
しかしである。わずか数日の査察(日本においては4日間)で査察官が発見することができる問題点・リスクは数が限られている。
したがって、査察官が発見したエラー(リスク)に対して是正を行えば自国民の安全が守られるということにはならない。
そこでFDAなどの査察では、エラー(リスク)を発見する査察手法から、当該企業が経営者のガバナンス(統治)のもと『品質システム(Quality System)』を確立しているかどうかを調査するといった手法に切り替えている。
QSIT(Quality System Inspection Technique)とは
- FDA査察官のための査察マニュアル。FDA査察の項目と順番を知って、査察の手口を理解する必要がある。日本でもQSIT査察が実施されている。
- 単なる製造管理や品質管理ではなく、品質保証全体のシステムを査察する技術
- 経営者による管理をマネジメントの中心においた査察技術
- 設計、製造、品質保証、流通、据付活動に適切な経営リソースを提供し、品質システムを機能させ、監視し、調整を行う
- 執行責任を持つ経営者が、品質システムを確立しているか判断すること。
- トップダウン監査
個々の事象から出発する(ボトムアップ)のではなく、システム(文書)→証拠(記録)
QSITガイド
FDAの査察対応 ~4つの領域~
- FDAの査察では、QSITが用いられ、4つの領域について詳しく調査される。
•CAPA(是正処置/予防処置)•経営管理•製造管理•設計管理
- FDA査察は、単なる製造管理や品質管理ではなく、品質保証全体のシステムを査察する。
- 特に経営者による管理を中心においている。
QSITガイド
Guide to Inspection of Quality Systems

監査担当者の要件
- 監査担当者は、物事を第三者的に観察し、ロジカルに矛盾点や問題点、課題点の抽出と原因究明および解決策の提示を行わなければならない。
- FDA査察官と同等のスキル・洞察力・経験を有していること。
- 経営者から権限を与えられていること。
- QAが機能しており、QMSが有効であるかどうかを監査すること。
- 経営者直轄の組織とすること。

監査員認定までの流れ

監査員の認定ステップについて
監査員研修(1回目)
- 広く監査員候補者(規制要件を理解していることが前提)を募り、研修を実施。
- 理解度テスト(筆記試験)により合格した者のみ2回目の受講資格が与えられる。
監査員研修(2回目)
- 理解度テスト(筆記試験)に合格した者が、監査員候補者としてQualifyされる。
監査員の認定ステップについて
実地訓練(OJT)
- Qualifyされた候補者は、当社の監査員に随行し、内部監査を実施する。
- 監査計画書の作成、監査チェックリストの作成、監査報告書の作成を含む。
当社監査員と同席監査
- 当社監査員と同席監査を実施し、同レベルの監査報告書が作成できることを確認する。
-
監査結果を精査し、合格と認められる者が監査員としてCertifyされる。
※上記2ステップの実施は任意です。貴社内で実施頂くことも可能です。
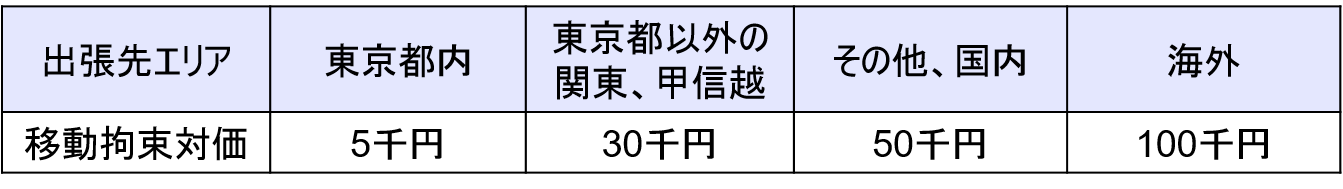
費用について

出張に伴う移動拘束時間に対する対価について