FDA査察対応支援コンサルテーション ㈱イーコンプライアンス
ベンダー向けコンサルテーション
◆ FDA査察対応支援コンサルテーション
貴社における課題と問題点の理解
[ 問題・課題 ]
- 近い将来FDAの査察を受ける可能性がある。
- これまでコンピュータに関してCSVやPart11などの信頼性保証を十分にやってこなかった。
- これまでにFDAの査察を受けたことが無く、対応のための準備方法が不明である。
[ ご要望 ]
- 21 CFR Part11に対応するためのドキュメントを明らかにしたい。
- 必要最低限の準備でFDAの査察に合格したい。
- コンピュータシステムの信頼性保証は、今後も継続して実施していきたい。
貴社のゴールと本プロジェクトのゴール
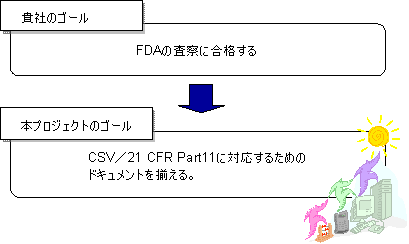
本コンサルテーションにおけるアプローチ
本コンサルテーションは、まずFDAの査察に合格できる必要最低限のドキュメンテーションを構築いたします。
FDAの査察においては、満点を取ることではなく、及第点を少し上回ることを目標とします。具体的には、Warning Letterが出されること無く完了することです。(483フォームの指摘については出される可能性は残ります。)
Part11対応SOPに関しては、査察で調査され得る、ポリシー、役割と責任、ガイドライン程度とします。
加えて査察官の関心のある、コンピュータシステムの改善計画(インベントリー、GAP分析等を含む)や、運用面(検索性、正確性、セキュリティ)における充実を図ります。
ただし、本コンサルテーションは、貴社のFDA査察合格をご支援するものであって、保証するものではありません。あくまでも担当官、貴社における対応・回答等により、大きく変化するものであることをご承知おきください。
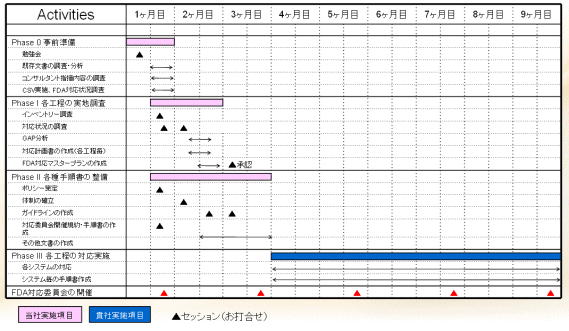
FDA対応のためのステップ
 |
 |
 |
 |
 |
| Phase 0 啓発活動 (教育) |
Phase I 実地調査 (GAP分析) の実施 |
Phase II 各種手順書 の整備 |
Phase III 各工程の 対応実施 |
|
|---|---|---|---|---|
| ・既存の貴社文書の調査・分析 ・模擬査察の実施内容の調査・理解 ・バリデーション実施状況調査 ・啓発活動 |
・貴社作成文書・記録の調査 ・対応状況の調査 ・GAP分析 ・対応計画書の作成(各工程毎) ・FDA対応マスタープランの作成 |
・FDA対応ポリシーの策定 ・FDA対応組織の確立 ・FDA対応ガイドラインの策定 ・対応委員会開催規約・手順書の作成 |
・GAP分析、優先順位に基づいたシステム(分析機器)毎の対応 ・システム毎の手順書の整備 | ・システムインベントリーの更新 ・進捗状況の確認 ・新規導入システムの対応 |
FDA対応委員会の開催
当社コンサルタントが、定期的にFDA対応委員会に出席いたします。
FDA対応委員会は、作成した開催規約や手順書に基づいて実施して頂きます。
各工程からの状況をヒアリングし、適切な助言を与えます。
定期的にインベントリーを更新いたします。
また適宜FDA対応に関して、例外処理、逸脱の是正等に関しての議論を実施いたします。
必要に応じて、業界動向、規制当局の動向等を解説いたします。
- 各工程の進捗状況のヒアリング
- インベントリーの更新
- 各種助言
- 例外対応、逸脱の是正指導
- 質疑応答
- 議事録の作成
- 業界動向・規制当局の動向解説
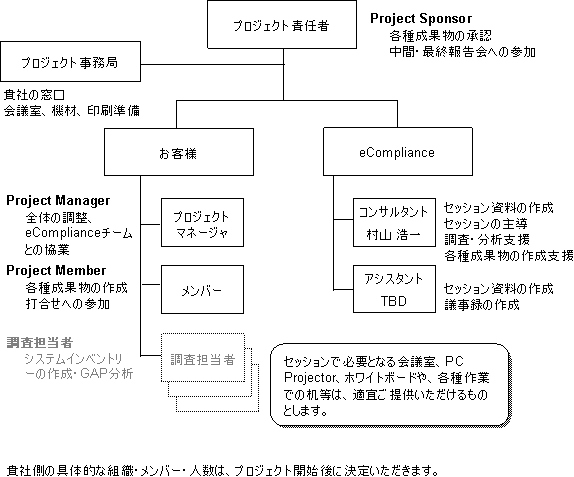
プロジェクト責任者の下に、検討チームメンバーを選任いただき、弊社コンサルティングチームと協働作業でプロジェクトを進めます。打合せでは、関連部門の関係者の方々にご協力をいただきます
スケジュール概要
サービス内容と概算価格
| サービス名 | サービス内容 | 概算価格 |
|---|---|---|
| プランA | ・サンプルドキュメントをご提供いたします。 (プランC参照) ・セッション(18回)に基づき、全てのドキュメントのドラフト作成を弊社が担当し、貴社がレビュし、弊社でレビュ結果を元にリバイス、最終化いたします。 ・弊社で議事録を作成します。 |
1,000万円 |
| プランB | ・サンプルドキュメントをご提供いたします。(プランC参照) ・セッション(18回)に基づき、貴社でリバイスして頂きます。リバイスしたドキュメントを弊社でレビュし、レビュ結果を貴社にフィードバックしますので、貴社で最終化して頂きます。 |
800万円 |
| プランC | ・サンプルドキュメントをご提供いたします。 ・CSV/Part11対応ポリシー(各1部) ・CSV/Part11対応の役割と責任(各1部) ・CSV/Part11対応のガイドライン(各1部) ・Part11対応基本計画書 ・Part11委員会の運営及び活動に関する手順書 ・Part11教育計画書 ・災害対策ポリシー ・セキュリティポリシー ・システムアクセス計画書 |
400万円 |