ALCOAについて ㈱イーコンプライアンス
ALCOAについて
最近、製薬業界ではデータインテグリティに関する関心が高まっている。
昨今の査察では、データインテグリティに絡んでのWarning Letterが多くなってきているためである。
ともするとデータインテグリティは電子記録にフォーカスされがちであるが、その要件は、手書き(紙)および電子によるデータの両方に等しく適用されるので注意が必要である。
データインテグリティという用語は、1997年8月に施行された21 CFR Part 11に伴ってFDAが最初に使用したものであると記憶している。
2015年1月、MHRA(英国医薬品庁)は「MHRA GMP Data Integrity Definition and Guidance for Industry」 (MHRA GMPデータインテグリティ 定義と業界へのガイダンス)と呼ばれるガイダンスを発出し、3月にはその改訂版であるRevision 1.1を発出した。さらに現在はGLP, GCP, GMP, GDP,GVPに拡大したガイダンスの改定を行っている。
さらにWHOでは、2016年5月31日に開催された 会議にて、Guidance on Good Data and Record Management Practices(GDRP)が承認された。
FDAにおいても4/14付で「Data Integrity and Compliance With CGMP」と題する企業向けドラフトガイダンスが発出された。
MHRA、WHO、FDAの各ガイダンスでは"ALCOA"と呼ばれる概念が紹介されている。
FDAは1999年4月に発行した「Computerized Systems Used in Clinical Trials」と呼ばれPart11の後に発出されたガイダンスとして、その序文において初めてALCOAの概念を明記した。
以下のように明記されていた。
『FDAが臨床試験データを受領するという決定は、オンサイトの査察や監査中に、データの品質やインテグリティを確認できるかどうかというFDAの能力にかかっている。
受け入れ可能となるためには、電子的に収集され記録されようとも紙媒体に記録されようとも、データは基本的な品質のエレメントに適合しなければならない。データは、属性を持ち、読みやすく、同時性があり、オリジナルであり、正確でなければならない。』
(FDA's acceptance of data from clinical trials for decision-making purposes is dependent upon its ability to verify the quality and integrity of such data during its onsite inspections and audits.
To be acceptable the data should meet certain fundamental elements of quality whether collected or recorded electronically or on paper.Data should be attributable, original, accurate, contemporaneous, and legible.)
ALCOAは、Attributable、Legible、Contemporaneous、Original、Accurateの頭文字をとったものである。
つまりFDAが申請資料を信用するかどうかは、査察中に電子記録がALCOAの原則を満たしているかどうかを確認できるかどうかにかかっているということである。
このALCOAという概念は2007年5月に同ガイダンスを改定して発行した「Computerized Systems Used in Clinical Investigations」においても明記された。
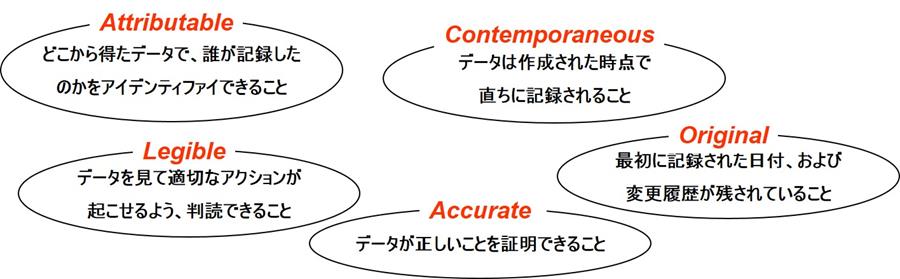
Attributable(属性を持つこと)とは、「どこから得たデータで、誰が記録したのかをアイデンティファイできること」である。
例えば、分析を実施した機器IDとその分析を実施したスタッフのIDが生データとともに記録されていなければならない。
Legible(読みやすくあること)とは、「データを見て適切なアクションが起こせるよう、判読できること」である。
例えば、電子記録の中に社員番号が"12345"と記録されていたり、男が"1"で女が"2"とか、入院が"1"で外来が"2"などのようにコ ード化されて記録されている、そのままのコードで画面表示したり、印刷しても意味が解せないのである。
Contemporaneous(同時性があること)とは、「データは作成された時点で直ちに記録されること」である。
分析を実施した後に時間が経過してから記憶に基づいて記録を作成してはならない。
Original(オリジナルであること)とは、「最初に記録された日付、および変更履歴が残されていること」である。
本邦におけるER/ES指針では真正性と称している、つまりデータが本物であるという証明である。
最初に記録された日付と変更履歴のどちらか一 方が欠如した場合、当該記録は本物であるという証明ができない。
Accurate(正確であること)とは、「データが正しいことを証明できること」である。
データが正しいことを証明するためには、多くの作業記録とチェックが必要となる。
例えば、分析装置の操作が間違っていなかったこと、試薬の調整を間違っていなかったこと、試薬の量を間違っていなかったこと、試薬の有効期限が切れていなかったこと、設定したパラメータが間違っていなかったこと、解析プログラムが間違っていなかったことなどを証明しなければならない。
イーラーニング
データインテグリティに関する規程・手順書
イーコンプレスでは「データインテグリティ規程」および「データインテグリティ手順書」のひな形の販売を開始いたしました。
データインテグリティ規程 55,000円(税込)
【目次】
1. 目的
2. 適用範囲
3. 用語の定義
4. 背景
5. データインテグリティの原則
6. データガバナンス
6.1 データインテグリティのためのステップ
6.1.1 教育およびコミュニケーション
6.1.2 リスクの発見および低減
6.1.3 技術およびITシステム
6.1.4 データガバナンス
7. 手順書等
8. 参考
9. 付則
ご購入は こちら
データインテグリティ手順書 55,000円(税込)
【目次】
1. 目的
2. 適用範囲
3. 用語の定義
4. 役割と責任
5. 啓発活動
6. 教育訓練
7. 関連する手順書の改訂
7.1 リスクマネジメント
7.1.1 リスクの検討
7.1.2 リスク低減策の検討
7.1.3 リスク低減策の実施
7.2 データライフサイクル
7.2.1 データの作成
7.2.2 データの処理
7.2.3 データのレビュ・報告・使用
7.2.4 データの保管・維持
8. コンピュータシステムの見直し、導入
9. 監視・測定
10. 監視・測定
11. 記録の保管
12. 参考
13. 付則
ご購入は こちら

