FMEAについて ㈱イーコンプライアンス
FMEAについて
厚労省が平成24年4月1日から施行した「コンピュータ化システム適正管理ガイドライン」の「5.1 バリデーションの全体計画に関する文書の作成 」には「バリデーション計画書には、必要な場合には詳細なリスクアセスメントについても記載すること。」という要求事項が記載されている。
しかしながらその「詳細なリスクアセスメント」についての実施方法など、一切の記述がない。
では一体「詳細なリスクアセスメント」とはどのようなものであろうか。
「詳細なリスクアセスメント」は別名を「機能リスクアセスメント(Functional Risk Assessment)」と呼び、ハードウェアやソフトウェアの機能単位でリスクアセスメントを実施するものである。
通常「詳細なリスクアセスメント」ではFMEA(故障モード影響解析:Failure Mode Effective Analysis:IEC 60812参照)を使用する。
FMEAは、以下のステップで実施する。
1.製品の品質、患者への安全性、データインテグリティに影響を与える可能性がある機能を特定する。
2.上記で特定した機能における失敗事象(例:データ入力ミス)を検討する。
3.上記各失敗事象において、欠陥の潜んだ製品が患者に届いた場合の重大さとリスクの起こり易さを比較した図表を作成しリスク分類を割り出す。(図左)
4.リスク分類と検出確率を比較した図表を作成しリスクの優先性を割り出す。(図右)
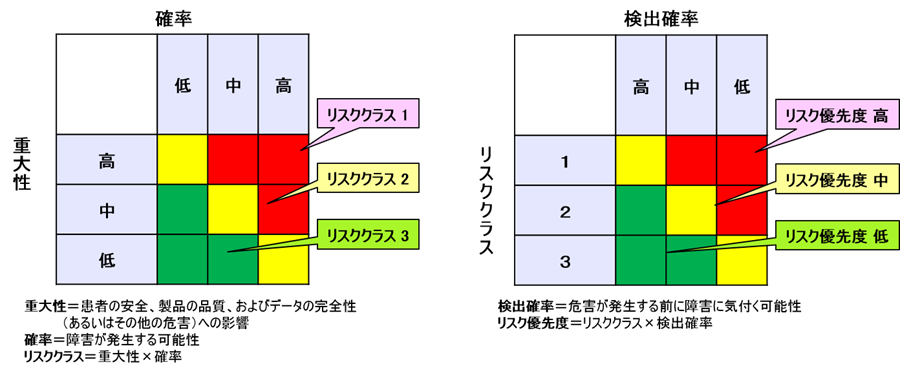
リスク=危害の発生の確率×重大性と定義されている。
3.(図左)においては「リスクの大きさ」を評価している。
我々は、この図を見るとリスクの大きい順(つまり赤→黄)に潰そうとするだろう。
しかしである、企業のリソースは有限である、つまり時間、コスト、労力などである。
有限であるがゆえに赤から潰していくと黄色の途中でリソースが尽きてしまうかもしれない。
ミドルリスク(黄色)といえども患者やユーザに出て行ってはならない。
そこでFMEAでは、4.(図右)において「リスク優先度(RPN)」を求めている。
リスク優先度(RPN)=危害の発生の確率×重大性×検出可能性である。
これは経済性を優先した考え方なのである。
つまり、リスクは設計において回避または低減することが望ましいが、コストがかさむ可能性がある。
そこで、ハザードが暴露した際に、検出することができれば、結果的に患者に欠陥のある製品が届くことがないのである。
医薬品の場合はバッチごと廃棄することとなり、医療機器の場合は手直し(リワーク)等を実施することとなる。
したがって、図で分かるように検出可能性が低いものほどリスク優先度が高くなっているのである。
FMEAを使用することにより、潰さなければならないリスクが半減する。
【医療機器設計においてFMEAは使用してはならない】
機器の設計においてFMEA(検出可能性)は使用しないこと。
なぜならばISO-14971では検出可能性は定義されていないからである。
医療機器の場合、検出可能性に関係なく、リスクが受容可能性を超えているものはリスクコントロールが必要である。
そもそもリスク優先度(RPN)は、患者、ユーザには無関係である。
FMEAは、工程設計において使用すること。
さらに詳しく知りたい場合は、当社のイーラーニングを参照していただきたい。
リスクマネジメントに関する書籍
 |
【要点をわかりやすく学ぶ】 製薬・医療機器企業におけるリスクマネジメント |
|
≪ここがポイント≫ 医薬品・医療機器それぞれのリスクマネジメントを初心者にも解りやすく解説! ・リスクマネジメントの全体像の把握と個々のアセスメント手法の理解 ・リスクベースドアプローチとは?? ・FDAが求めるリスク管理と査察対応 ・医薬品・医療機器のリスクマネジメントの差異と各特徴・留意点 ・「リスク」と「ハザード」の違いと各特定方法、マネジメント手法 【発刊日】2015年8月28日 【著 者】株式会社イーコンプライアンス 代表取締役 村山 浩一 |
筆者が常日頃から思ってきたことは、医薬品(ICH-Q9)や医療機器(ISO-14971)に関するリスクマネジメントのセミナーや書籍が皆目ないということである。その理由は定かではないが、おそらくいずれも非常に難解であることと、網羅的に実践した経験者が圧倒的に少ないことに起因するのではないかと思われる。
本書では、医薬品と医療機器のリスクマネジメントを両方取り扱う。医薬品と医療機器では、リスクマネジメントに関する対応方法や対象が異なる。
しかしながらそのプロセスはほぼ同じである。
医薬品と医療機器で、どのようにリスクマネジメントの実施に差異があるかということにも言及した。本書では、難解なリスクマネジメントについて、できる限りわかりやすく執筆したつもりである。本書が、読者諸兄のリスクマネジメントへの理解を深める一助となり、より安全な医薬品・医療機器を世の中に出せることを願っている。
(はじめに 抜粋)
ご購入はこちら。
リスクマネジメントに関する規程・手順書・様式
 |
【ISO14971:2007対応】 リスクマネジメント規程・手順書・様式 |
| ISO14971:2007に沿った形のリスクマネジメント規程・手順書・様式です。 医療機器設計におけるリスク分析は、ISO-14971に従って実施されています。 リスクマネジメント実施のための手順や様式を整えておかなければなりません。 これから作成する医療機器企業やISO-14971認証審査を予定している企業、認証機関から改善指示を受けた企業向けに、サンプルをご用意いたしました。 MS-Word形式ですので、貴社でご自由に加筆・修正を行っていただけます。 |
≪様式一覧≫
※ご注文いただきますと、以下の様式を電子メールにて Wordファイル形式で納品いたします。
・MD-QMS-K5 リスクマネジメント規程
・MD-QMS-S501 リスクマネジメント手順書(ソフトウェアあり)
・MD-QMS-S501 リスクマネジメント手順書(ソフトウェアなし)
・MD-QMS-F501 ハザード項目検討票
・MD-QMS-F502 リスクマネジメントワークシート(ソフトウェアあり)
・MD-QMS-F502 リスクマネジメントワークシート(ソフトウェアなし)
・MD-QMS-F503 リスクマネジメント計画書テンプレート
・MD-QMS-F504 リスクマネジメント報告書テンプレート
ご購入はこちら。


