根本的原因の重要性とは ㈱イーコンプライアンス
根本的原因の重要性とは
原因の究明と再発防止が最重要
1985年(昭和60年)8月12日に日本航空123便 ボーイング747SR100型機 (JA8119) 羽田空港18:00発 伊丹空港行が、離陸12分後から32分間の迷走飛行の末、群馬県多野郡上野村の山中に墜落した。
乗員・乗客あわせて524名中520名もの尊い命が奪われた。
旅客機の単独事故としては、世界でも最大の犠牲者数を出した事故である。
墜落の原因はボーイング社による後部圧力隔壁の修理ミスとされている。
米国では故意か重大な過失がない場合、刑事責任を問わない。
また米国では「司法取引」といわれる制度もある。
事故の原因の犯人捜しを行った場合、多くの証拠書類は秘匿され、また関係者の証言を得ることは困難になるであろう。
事故が起きたことは非常に残念ではあるが、重要なことは悲惨な事故を2度と繰り返さないことである。
そのためには、徹底的な「根本的原因」の追及が必要である。根本的原因が見付からなければ、事故は再発するのである。
根本的原因の考え方と是正処置実施
是正処置には必ず根本的原因(Root Cause)の除去がある。
発見された不適合事項に対して是正処置を実施する上で、最初に検討しなければならないことは、発生した不適合の原因を究明し、根本的原因を特定することである。
しかし、根本的原因を特定するといっても、そう簡単ではない。
筆者がコンサルテーションを実施する中で、CAPAに関する実習を実施することがあるが、多くの実習者は根本的原因の抽出ができない。
多くの場合、根本的原因を人や製品固有の問題としているケースが見られる。
- 教育訓練が不足していた
- 理解(認識)不足であった
- ~と思っていた
- ~が出来ていなかった
これらは原因ではあるが、根本的原因ではない、根本的原因を抽出する際の一番多い間違いである。
是正処置は、個人的なもの(人の規律・注意力・自覚などの人為的要素)や製品単独なものに終わってしまっては、また再発するおそれがある。
"教育訓練を徹底させた"などという是正処置はあり得ない。
なぜならば、教育を受けたり厳重注意を受けた者はミスを繰り返さないかもしれない。
しかしながら、企業における組織では常に要員は交代する。
交代した場合、前例は生かされず同じミスを繰り返す(つまり再発する)可能性があるからである。
是正処置の考え方と実施
根本的原因として、仕組み的な欠陥・弱点・不備・矛盾・曖昧さを追求しなければならない。
是正処置(再発防止)の核心は、仕組み(QMS)的な欠陥・弱点・不備・矛盾・曖昧さに対して対処すること。
組織のノウハウとしてシステムに組み込むことによって、再発防止がなされるのである。
人間の本質は怠惰・怠慢である。
規律や注意力に依存するシステムはいつまでも同じクオリティを持続できず、どこかで誰かが同じような問題を再発させる。
再発しないようにチェックがなされる仕組み(システム)をつくることが必要となる。
重要なことは、顧客苦情、不適合、ミス、ロスなどを未然に防ぐように、確実に仕組み(QMS)に組み込む方法を構築することである。
根本的原因を見極める
根本的原因を除去するためにはあらゆる原因を究明しなければならない。
原因を究明して特定することが是正処置には欠かせない、原因の究明なくして是正処置はあり得ない。
なぜこのような事態を引き起こすようになったのか、その"なぜ"を見極める必要がある。
主な原因分析手法には以下のようなものがある。
- 5Whys(なぜなぜ分析)
- KJ法
- フィッシュボーン分析
- 3人以上で討議
- FTA
- FMEA
特に設計問題や製造問題を解決する際に最も強力なのがFTAである。
(FTAに関する詳細はこちら)
筆者がコンサルテーションを実施する中でしばしば残念に思うことは、医療機器企業において顧客苦情を受けた際に再現実験を十分に実施していないということである。
苦情を受けた故障などを再現させることができず(または当初から諦めて)、修理のみを実施し顧客へ返品しているケースを多く見受ける。
再現できない場合、根本的原因は見つからず、同じ故障が繰り返されることとなる。
このような不適切な根本的原因の調査を実施している場合、顧客苦情は絶えないであろう。
CAPAの重要性
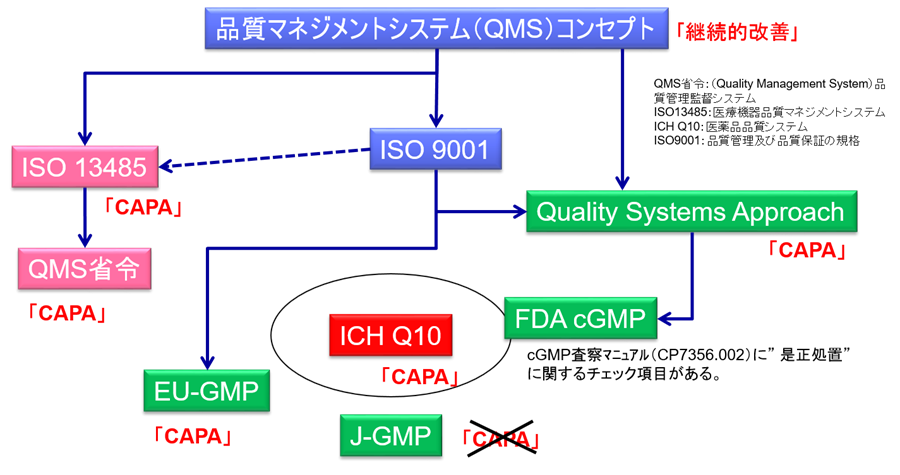
CAPA(Corrective Action and Preventive Action:是正処置・予防処置)は、医療機器業界では規制要件や国際規格であるISO-13485において実施が要求されている。
一方において、製薬業界においてはCAPA要求は、GMPには記載がない。(図参照)
したがって、CAPAの実施が必須であることに気付いていない製薬企業も存在している。
ISO-9001:2015においては予防処置に関する箇条がなくなったことは、こちらを参照下さい。
1970年代に日本の自動車が米国を席巻した。低価格にもかかわらず、低燃費かつ米国車に比べて故障が非常に少ない。
危機感を感じた米国3大モータースは、徹底的に日本の自動車産業における品質管理を研究した。
その結果「改善」という日本流の品質管理システムを見出した。「KAIZEN」という用語は、「ありがとう」「さよなら」「つなみ」などと並んで世界において通用する日本語の一つである。
改善を突き詰めるとCAPAに至る。CAPAは日本式の品質管理から生まれ、米国においてシステム化された。
実は「改善」という言葉はGMP省令中にも記載がある。
FDAによるとCAPAにおいて重要な事項の一つは「タイムリーな救済」である。
つまりCAPAには期限管理が必要である。SOPにおいて事象の発生から調査開始まで、是正処置の決定まで、是正処置の実行までなどのように実施期限を規定しておかなければならない。
ISO-13485:2016においては、CAPAにタイムフレームが要求されることとなった。
製薬企業においてCAPAが重要となるのはOOS(Out of Specification:規格外製品)の処置であろう。
OOSとなった場合、製造工程におけるその根本的原因を究明し、再発を防止しなければならない。
その場合、根本的原因は製造工程のみとは限らない。品質試験に原因があるかも知れない。
医療機器においては不適合製品が発見された際に、「特別採用」という処置が存在する。
特別採用が実施できるのは、顧客要求基準には入っているが、自社基準(許容公差など)からはみ出ている場合等に実施することができる。
しかしながら、特別採用の実施は1度しか許されない。なぜならば特別採用を連発するとモラルハザードが起きるからである。つまり「製造仕様」を遵守しなくても良いといった風潮に安易に流されてしまう。
特別採用を実施した場合、2通りの処置のいずれかを採らなければならない。
- 設計変更により許容公差を広げる
- CAPAを実施することにより工程を変更し再発を防止する
CAPAに関する規程・手順書・様式
 |
【FDA CFR 820 QSR対応】 CAPA規程・手順書・様式 |
| FDA QSRに沿った形のCAPAに関する規程・手順書・様式集です。 QSR(品質システム規則)査察で最も指摘が出されているのがCAPAです。 これから作成する医療機器企業やISO-14971認証審査を予定している企業、認証機関から改善指示を受けた企業向けに、サンプルをご用意いたしました。 MS-Word形式ですので、貴社でご自由に加筆・修正を行っていただけます。 |
ご購入はこちら。
 |
【ISO-13485:2016対応】 CAPA規程・手順書・様式 |
| ISO-13485:2016に沿った形のCAPAに関する規程・手順書・様式集です。 QSR(品質システム規則)査察で最も指摘が出されているのがCAPAです。 これから作成する医療機器企業やISO-14971認証審査を予定している企業、認証機関から改善指示を受けた企業向けに、サンプルをご用意いたしました。 MS-Word形式ですので、貴社でご自由に加筆・修正を行っていただけます。 |
ご購入はこちら。
≪様式一覧≫
※ご注文いただきますと、以下の様式を電子メールにて Wordファイル形式で納品いたします。
・ MD-QMS-F1701 CAPAフォーム
・ MD-QMS-F1702 CAPA一覧表
・ MD-QMS-F1703 CAT会議記録
・ MD-QMS-K17 是正処置・予防処置実施規程
・ MD-QMS-S1701 是正処置・予防処置実施手順書

