平成19年12月21日に行われた、製薬協EDC自主ガイダンス(臨床試験データの電子的取得に関するガイダンス)の説明会では、本ガイダンスはまだ試行錯誤の途上であること、電子症例データを原本とみなせる最低限の要件に過ぎないことなどの説明がありました。
つまり本ガイダンスを遵守したからといって、十分であるという保証はないのです。
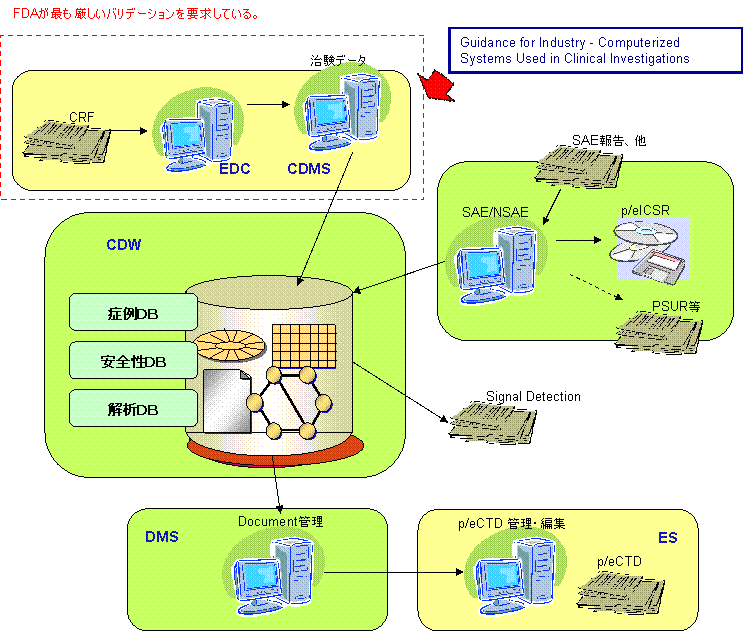
米国では、FDAが1999年5月に「Computerized Systems used in Clinical Trials」が発行し、2007年5月に「Computerized Systems used in Clinical Investigations」として改定しました。
EUにおいても、EMEAのGCP IWG(GCP Inspectors Working Group:査察官のワーキンググループ)が、2007年6月14日「Reflection Paper on Expectations for Electronic Source Documents Used in
Clinical Trials」を発表し、パブリックコメントの募集を2008年4月31日に締め切りました。
しかしながら日本の規制当局は、EDCシステムに関する通知を未だ発行していません。規制要件がはっきりしないままのEDCシステム運用は、大きなリスクを抱えることになります。
規制当局にとっても製薬企業にとっても、必要十分条件を明確化した上で、EDCシステムの運用を行うことが必要であるといえます。
関連法令
- 日本
臨床試験データの電子的取得に関するガイダンス
(平成19年11月1日 日本製薬工業協会 医薬品評価委員会) - 米国
「Guidance for Industry Computerized Systems Used in Clinical Investigations」
FDA 2007.5.11 - EMEA
REFLECTION PAPER ON EXPECTATIONS FOR ELECTRONIC SOURCE DOCUMENTS USED IN CLINICAL TRIALS
EMEA GCP INSPECTORS WORKING GROUP 2007.6.14
米国の状況
症例報告書の電子化に関する省令、通知、ガイドライン
厚労省ER/ES指針
- 目的
- 用語の定義
- 電磁的記録利用のための要件
3.1 電磁的記録の管理方法
3.1.1 電磁的記録の真正性
3.1.2 電磁的記録の見読性
3.1.3 電磁的記録の保存性
3.2 クローズド・システムの利用
3.3 オープン・システムの利用 - 電子署名利用のための要件
- その他
臨床試験データの電子的取得に関するガイダンスとは
- 臨床試験データを電子的に取得する際に最低限注意すべき事項について、業界の有識者が中心となって策定したもの
現在、EDCに取り組んでいるリーディンググループのノウハウが盛り込まれたもの - 厚労省ER/ES指針をEDCで具現化するために、特に注意すべき点をより具体的に検討されたもの
- CRFをペーパーレス化できる要件を定義(電子CRFを原本とできる)
- ASPを利用した形態でのガイダンス
- 電子CRF原本の唯一性を要求
- 現時点で、EDCに特化した規制当局による通知等は未整備
- 試行錯誤の途上にあり、今後、詳細な要件が検討されるべき
関連法令、レギュレーションリンク集
- 「医薬品の臨床試験の実施の基準に関する省令」(厚生省令第28号) 平成9年3月27日
- 「電子署名及び認証業務に関する法律」 平成12年5月31日 法律第102号
- 「民間事業者等が行う書面の保存等における情報通信の技術の利用に関する法律」平成16年 法律第149号
- 「医薬品の臨床試験の実施の基準に関する省令の一部改正(医薬品GCPの一部改正)」 (厚生労働省令第172号)平成16年12月21日
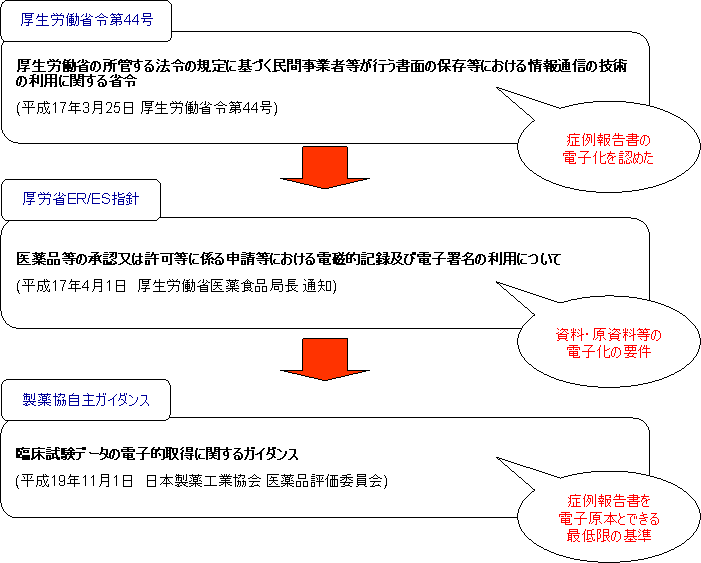
- 「厚生労働省の所管する法令の規定に基づく民間事業者等が行う書面の保存等における情報通信の技術の利用に関する省令」(厚生労働省令第44号)平成17年3月25日
- 「医薬品等の承認又は許可等に係る申請等における電磁的記録及び電子署名の利用について」(薬食発第0401022号) 厚生労働省医薬食品局長 平成17年4月1日
- 「医薬品の臨床試験の実施の基準の運用について」 (薬食審査発第0921001号) 厚生労働省医薬食品局審査管理課長 平成18年9月21日
- 臨床試験データの電子的取得に関するガイダンス 平成19年11月1日 日本製薬工業協会 医薬品評価委員会
- 「Title 21 of the Code of Federal Registers Part 11, “Electronic Records; Electronic Signatures”」 FDA 1997.8.20
- 「Guidance for Industry; Computerized Systems used in Clinical Trials」 FDA 1999.5
- 「General Principles of Software Validation; Final Guidance for Industry and FDA Staff」 FDA 2002.1.11
- 「Guidance for Industry Part 11, Electronic Records; Electronic Signatures - Scope and Application」 FDA 2003.9. 5
- 「Guidance for Industry ; Computerized Systems used in Clinical Investigations」 FDA 2007.11. 5
- 「Reflection Paper on Expectations for Electronic Source Documents Used in Clinical Trials」 EMEA GCP IWG(GCP Inspectors Working Group) 2007.6.14



