医療機器企業向けコンサルテーション FDA査察対応支援 ㈱イーコンプライアンス

FDA査察対応支援
貴社では、以下のような課題をお持ちではないでしょうか。
- FDAから査察実施の連絡があった。
- 近い将来FDAの査察を受ける可能性がある。
- これまでにFDAの査察を受けたことが無く、対応のための準備方法が不明である。
- これまでコンピュータに関してCSVやPart11などの信頼性保証を十分にやってこなかった。
米国へ医療機器を輸出している企業は、FDA査察を拒否することができません。
FDA査察で不合格になった場合は、米国税関当局で輸入が差し止められます。
FDA査察対応に関する詳しい記事は、こちらを参照してください。
イーコンプライアンスでは、以下のようなサービスをご提供することができます。
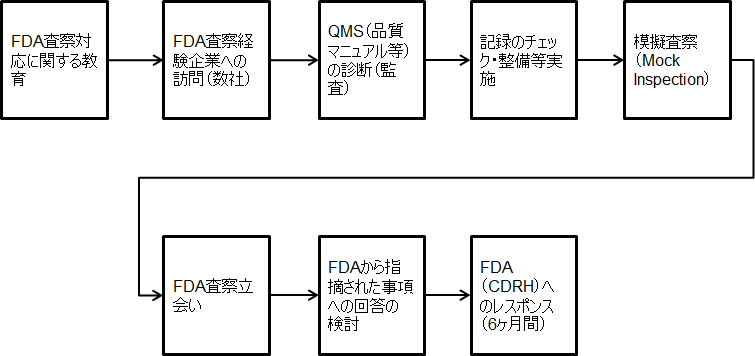
FDA査察対応コンサルテーションの流れ
FDA査察対応コンサルティングサービスメニュ
| No | 作業項目 | 内 容 | 工数 | 費 用 (税 別) |
|---|---|---|---|---|
| 1 | FDA査察対応教育 | QSR、査察対応に関する教育を実施いたします。 FDA査察官はどういった観点から貴社のQMSを調査しに来るのか、また、対応者の皆様がQSRについてご理解いただけるように要点を絞って解説いたします。 本教育は、査察対応される方々にQSRや査察対応に関する知識をつけてもらうことが目的です。 | 8時間 | 32万円 |
| 2 | 外部監査実施(ウィークポイントの抽出) | 弊社がFDA査察官の知見からQMSを調査し、問題点(弱み)を見つけ出します。 監査実施後、見つけ出した問題点に対しCAPAを起票していただき、FDA査察当日までに問題を無くします。 FDAが指摘しそうな問題点について、改善済みであることを査察官に説明できるため、査察時の指摘リスクを大幅に低減することができます。 | 8時間 | 32万円 |
| 3 | FDA査察対応計画書作成 | FDA査察を乗り切るために、いつまでに何を実施しなければならないか、事前に計画を立て、文書化いたします。
査察時に提示する資料の準備、備品の用意、対応者の決定、査察会場のレイアウト設定等、あらゆる内容を本計画書に記載していきます。 | 8時間 | 32万円 |
| 4 | プレゼン用資料作成 | FDA査察開始時に、査察官に対し会社プレゼンテーションを行う時間があります。 査察官に貴社はどういった企業であるかをご理解いただくためにプレゼン資料を用意する必要があります。 弊社では、FDA査察官に貴社の第一印象を良く持っていただけるようプレゼンテーション資料の作成支援をいたします。 | 4時間 | 32万円 |
| 5 | CAPA、苦情、不適合品等の一覧表作成支援 | FDA査察時にCAPA、苦情、不適合品等のリストの提示が求められます。
各種リストに不備がないか、どういった案件が査察官に選ばれやすいか、査察官の目線で一覧表の作成を支援いたします。 | 24時間 | 96万円 |
| 6 | 模擬査察 | 文書の提供・回答の仕方をトレーニングいたします。
弊社が模擬査察官となり、本番さながらに模擬査察を行います。本番さながらの環境を作り出すことで、緊張感を持って取り組んでいただきます。 シニアコンサルタント・コンサルタントの2名で実施 | 16時間 | 112万円 |
| 7 | 最終確認 | 査察前日に、準備状況の最終確認をいたします。
製造現場、各種一覧表、記録等の準備、回答方法、備品の用意等あらゆる準備状況を最終確認し、満を持して査察本番を迎えるようにいたします。 査察本番直前の土日に実施いたします。 シニアコンサルタント・コンサルタントの2名で実施 | 16時間 (査察直前の土日) | 112万円 |
| 8 | FDA査察当日対応 | 査察に同席し、回答や資料提示、査察官の懸念への対応をご支援いたします。
査察官が求めている回答の妥当性・資料の適切性について、指示・助言等を行います。 また、査察官が懸念していることをいち早く察知し、改善を図ります。そうすることで指摘リスクの低減を図ります。 シニアコンサルタント・コンサルタントの2名で実施、夜間を含む。 | 48時間 | 336万円 |
| 9 | 指摘に対する回答作成支援 | 査察時に指摘が出された場合、査察終了後に指摘に対する改善計画等の回答について作成の支援を行います。
指摘内容により工数が変化するため費用は別途お見積もりとなります。 | - | - |
上記費用には、交通費・宿泊費などの実費、消費税は含まれておりません。
コンサルティング価格表はこちら。
出張に伴う移動拘束時間に対する対価について
研修実施、監査実施に伴う出張に関して、交通費・宿泊費の実費および以下の移動拘束時間に対する対価を申し受けます。(税別)
| 出張先エリア | 東京都内 | 東京都以外の 関東、甲信越 | その他、国内 | 海外 |
|---|---|---|---|---|
| 移動拘束対価 | 5千円 | 30千円 | 50千円 | 100千円 |


