製薬業界におけるグローバルプロジェクト

製薬業界におけるグローバルプロジェクト
*万が一文中に解釈の間違い等がありましても、当社では責任をとりかねます。
本文書の改訂は予告なく行われることがあります。
製薬業界におけるグローバルプロジェクト
要約
どの業種でも同じことが言えると思うが、世の中のグローバル化の波を迎え、製薬業界も積極的に海外展開に打って出なければならなくなった。
言葉も文化も違う日本にとって、海外への業務展開には数多くの問題が存在する。
最近重要視されてきているITの世界でも、グローバルスタンダードに適したシステムの採用が重要となってきている。
しかしながら一口にグローバルスタンダードといっても、日本の企業にとって克服すべき点は数多くある。
世界の大手製薬会社では、欧米での統合はかなり進んできている。しかしながら、日本を含めた3極を統合することは文化の違い、言語に違いもあいまってなかなか進んでいないのが現状である。
日本の企業が世界へ出て行くことが困難なように、外資系の企業が日本に参入するにも数多くの困難がある。日本の文化のユニーク性や言語の違いといった、いわゆる非関税障壁にも似た障壁が存在する。最近、国産製薬企業および外資系製薬企業において、グローバルシステムの導入のお手伝いをすることができ、その経験から、今後同様の案件を扱う際の参考のために本論文をまとめた。
キーワード:製薬業界、グローバルスタンダード、プロジェクト管理
目次
1. はじめに
2. 製薬業界におけるグローバル化の背景
2.1. 製薬会社を取り巻く国際的環境
2.3. 製薬会社における新薬開発のスピードアップの重要性
3. 外資系製薬会社における日本市場への参入の障壁
3.1. グローバル化の壁
3.2. 日本市場への参入の遅れ
3.3. グローバルオペレーションへの移行
4. 国産製薬会社におけるグローバル展開の障壁
4.1. 最初のグローバリゼーション
4.2. 欧米先行型開発
5. 製薬業界におけるグローバルスタンダードを意識したITの導入プロジェクト. 14
5.1. 言語の問題
5.2. Word文書による英文ドキュメント作成時の注意点
5.3. 日本語MS-Word文書にGraphicsを描画する場合の注意
5.4. PDFファイルの利用
6. おわりに
1.はじめに
製薬業界では、規制緩和や薬価抑制の波を受けて、企業戦略の修正を余儀なくされている。
新薬を開発する製薬会社にとって、21世紀に生き残りをかけた企業戦略の立案は至上命題となっている。もはや日本国内の市場をターゲットにしているのみでは、今後の成長は望めない。
国産の製薬会社では、日本国内の限られたマーケットから、積極的に海外展開へとその方向性を変えつつある。
また一方で多くの外資系企業は、世界第2位の市場を持つ日本のマーケットに照準を定め、日本でのシェア拡大に躍起となっている。
製薬業界の特殊性として、市場に出す薬剤(すなわち製品)は、各国での臨床試験を経てそれぞれの当局に申請を行い、承認を得る必要があることがあげられる。
他の業種の多くは、どの国で開発された製品であっても、ほとんどの場合規格さえクリアしていれば各国において発売することができる。
たとえばテレビを例にとると、NTSCやPALといった映像方式が合致してさえいれば即市場に出すことができる。
薬品の場合は、生命に与える危険性などの観点から、各国の規制要件をクリアした上で、臨床試験を行い、また各国で定められた申請方法によって申請書を作成しなければならない。
また発売後の製造指針や市販後調査等に関するガイドラインも定められており、研究開発の段階から世の中に出たものまで一貫して当局の厳しい管理下におかれていることになる。
日本の厚生省におけるガイドラインは、欧米におけるそれと比べて、非常にユニークであり、特殊性を持ったものになっている。
このことは、外資系製薬企業の日本への進出を阻害してきた大きな一因となっていた。
また、同様に日本の製薬会社が海外に進出する場合に、各国の法律やレギュレーションに対応することが必要となることは言うまでもない。
国際化を志向している国産製薬メーカーに対し、ITシステムを含めたグローバル化のサポートニーズが存在する。つまりグローバルスタンダードの採用は経営戦略上、不可欠となりつつある。
- 日本の市場に照準を定めている外資系企業にとって、日本の規制要件、文化、習慣について融和したグローバルプロジェクトを策定することが必要である。また日本における言語(2バイトコード)の問題から、ITシステムを導入する際のサポートニーズがある。
筆者は、これまで外資系製薬会社および国産製薬会社のそれぞれにおいて、グローバルな観点からのITシステムの導入をした経験をもっている。 本論文では、これらの経験をベースに、グローバルプロジェクト管理およびグローバルスタンダードを導入するにあたっての問題点や、注意点を中心に論じた。
2. 製薬業界におけるグローバル化の背景
2.1.製薬会社を取り巻く国際的環境
世界の大手製薬企業といえども、生き残りをかけた事業の見直しを迫られている。一説によると、21世紀に生き残れるのは、20社とされている。
これまで日本の多くの製薬会社は、国内での販売を中心に、一定した成長を遂げてきた。
しかしながら、多大な費用と時間をかけて開発された新薬は、できるだけ多くの国で発売されることが望ましい。日本の製薬企業にとっても、世界市場で受け入れられる新薬の開発は必須となった。
薬剤を世界市場で発売するためには、当然ながら各国の規制当局によって新薬が審査され承認を得る必要がある。医薬品の承認審査には各国・地域固有の基準があり、一国で承認を取っても別の国では改めて安全性や有効性のデータを取り直さなければならなかった。
しかしながら、動物実験や臨床試験といった倫理上の問題や、画期的な新薬をより早く世の中に出すという目的から、日米欧の規制当局と製薬業界が集まって、各種の基準を三極で統一し、相互にデータを受け入れるようになってきた。
また一方において、多くの外資系製薬会社にとって、日本の市場はとても魅力的であるといえる。
何故ならば日本の製薬マーケットは、米国に継いで2番目に大きくおよそ6兆4千億円である。また世界の医薬品の売上の約20%を占めているのである。
2.2.製薬会社における新薬開発のスピードアップの重要性
図2に示す通り、製薬会社の利益は、市販後の売上(B)の面積から研究開発費(A)の面積を引いたものになる。製薬業界の特徴として、Bの面積は容易に大きくすることはできない。*1
________________________________________________________
*1 患者の総数 ― つまり需要は大きく変化しない。また医科向けの薬剤は広告宣伝活動が禁じられているなどの理由による。
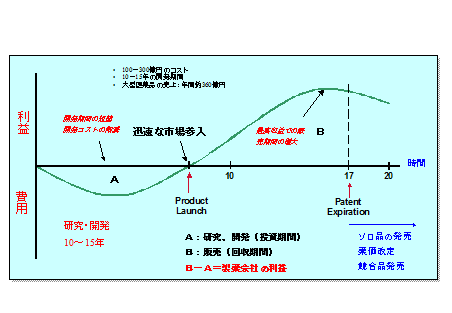
図1 製薬会社におけるキャッシュフロー
従って利益の最大化のためには、開発期間の短縮がとても重要であるといえる。
例えば、年間360億円を売り上げる薬剤の場合、開発期間を1日短縮することによって、1億円の利益をもたらすことになる。新薬を開発する製薬会社では、“Fast Time to Market”を掛け声に、開発期間の短縮に努めている。
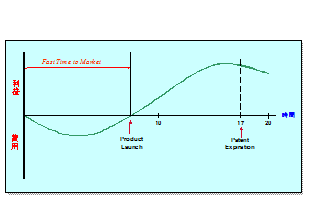
図2 Fast Time to Market
図3に示すように、かつては新薬の発売から、他社による後発品の販売までは10年もの期間がかかっており、その間に先行品を発売した会社は利益を悠々と回収することが出来たものである。
しかしながら昨今では、先行品の発売から後発品の発売まで1年を切るものもあり、市場の独占が非常に短期間となってきている。
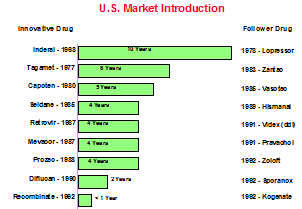
図3 先行品発売から後発品の発売までの期間
(TWG資料による)
また新薬の特許は15年間*2しか有効でないため、特許期限が切れたら、同一成分を使ったゾロ品*3の製造および販売が認められている。 ゾロ品は一般に開発コストが安価であるため、市場価格も低く抑えることができる。図4に示すとおり、かつてはゾロ品発売後も緩やかに市場のシェアの低下が起こっていたが、現代のアメリカにおいて、保険会社等の意向によってゾロ品発売以降は、先発品は急速に市場のシェアを失う結果となっている。
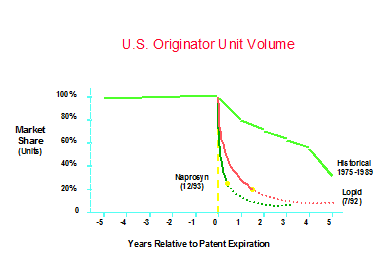
図4 ゾロ品発売後の先発品のシェア低下速度
(TWG資料による)
____________________________________________________
*1 開発が5年以かかったものは、新薬承認後5年間は保証されることになっている。
*2 業界用語。よく売れるくすりがあると、それと同じ成分のくすりが多くの会社からゾロゾロと発売されるので、そう呼ばれている。こうした薬はアメリカやヨーロッパでも結構出回っていて、ジェネリック(一般名医薬品)とかミー・トゥ・ドラッグ(ものまね薬品)という言い方がされている。それに対して、最初にその薬を開発した会社の製品は「銘柄品」とよぶことが普通。
以上のような理由により、図5に示すとおり、かつてのような製薬会社におけるキャッシュフローは、侵食される現象が起きている。 新薬の発売開始が遅れるのみならず、開発コストの増大や、市場シェアの低下、薬価の抑制などにより、利益はますます圧迫されているのである。
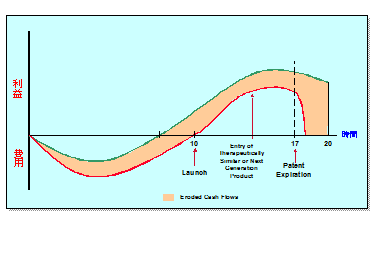
図5 キャッシュフローの侵食
圧迫されつづける利益を下支えするためにも、世界市場で新薬を発売することはとても重要となっている。(図6)
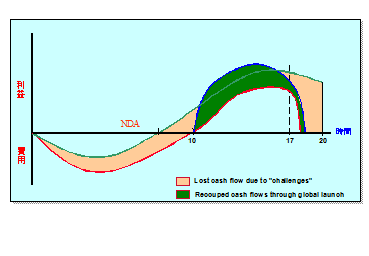
図6 世界市場での発売の重要性
3. 外資系製薬会社における日本市場への参入の障壁
3.1.グローバル化の壁
あるヨーロッパの製薬会社の日本法人の社員からこんな話を聞いたことがある。
「日本人にとってグローバルとは世界全部のことである。ところがヨーロッパの人にとって、グローバルとは欧米のことである。」と。
つまり、ヨーロッパにある本社は日本のことを、世界の一員として見ていなく、余り重要視していないというのである。やはり世界でもっとも大きな市場であり、リーダ的存在であるアメリカの方を向いてビジネスを行うのは必然的なことであろう。
この話にはまだオチがあって、「なんとアメリカ人にとってグローバルは、アメリカ全土のこと」というのである。
確かにいまだにアメリカでは、メートル法ではなくマイルを使用しているし、重量もグラムではなく、ポンドになっている。グローバルスタンダードに一番遅れているのは、実はアメリカなのかもしれない。
多くの外資系製薬会社のグローバル戦略は、欧米を中心に行われてきた。同じ英語圏でもあり、また比較的文化も似通っているのでしごく当然のことといえる。
しかし、その視線を日本に向けた途端に、思いもしなかった障壁が待ち構えているのである。
ある外資系製薬会社のシステム導入担当者から、日本の市場への進出には2つの大きな障害があると聞いたことがある。それは、「言語と文化である」というのである。
つまり日本語という非常に大きな非関税障壁がある。
また得てして、日本の文化は欧米から理解されにくい点があることも否定できない。
欧米に比べて、日本の文化がユニークなのは万人が認めるところであろう。またITが進歩する中、電子メールやウエブサイトといったものが多く利用されてきているが、日本では日本語つまりダブルバイトをハンドリングしないといけないというハンディキャップがある。
3.2.日本市場への参入の遅れ
Lilly社をはじめ多くの大手外資製薬会社は、欧米での新薬同時発売を実現している。(図7)しかしながら、日本市場に対する発売までには欧米に遅れること1年以上のギャップがあるのが通常である。
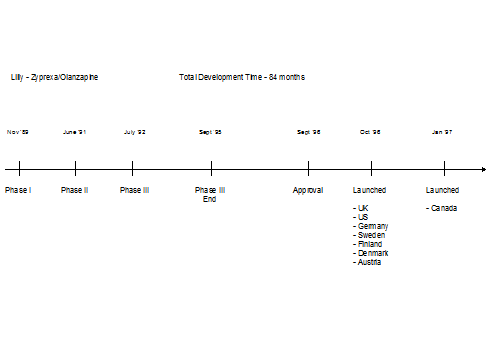
図7 Lilly社におけるGlobal Launchの例(TWG資料による)
ある米国製薬会社では、抗リューマチ薬で既に世界中で年間2,000億円もの売上を誇り、市場性が確認されているにもかかわらず、日本では臨床試験すらはかどらないといった問題を抱えているところもある。
またその会社では、抗がん剤の臨床試験において、たった20症例のデータをフィックスし総括するのに半年以上もかかっているという。
多くの場合、外資系製薬会社の本社は、日本法人に対して開発の迅速化を求めるにとどまっており、グローバルに統一したオペレーションに移行する方針が見られない。
これはやはり日本の行政の特殊性と文化の違いが大きいからだと考えられる。
筆者が感じるところによると、ほとんどの場合、外国の本社は日本の事情を汲み取る努力を行わないばかりか、どう違うのかを理解しようともしていないように思われる。
今後は、本社によるグローバルオペレーションに対して、日本からの要求をする努力が不可欠であると思われる。
一方、日本法人から見た本社との関係における問題点もみられる。
- 本社の全臨床データの検証・治験薬概要書の作成体制が不十分
- 本社のカウンターパートに対するサイエンテストが不足している
- 本社からのプロジェクト立上げ情報の入手に時間がかかる
- 海外情報が紙ベースで提供され、コピー等の事務作業が多い
- 症例データベースの設計標準・コード標準がない
- 申請書作成の共同作業に対してITサポートが弱い
- 本社で採用しているITシステムは、日本語バージョンがなく日本で導入できない等である。
これらの問題点は、多くの外資系製薬会社に共通しており、各社が今後対応をしていかなければならない事項である
3.3.グローバルオペレーションへの移行
ここにある外資系製薬会社の、グローバルオペレーションに対する取り組みの例がある。
前述したように、現在までは欧米の統合を中心に行われてきたが、日本においても極力統合をはかろうというものである。
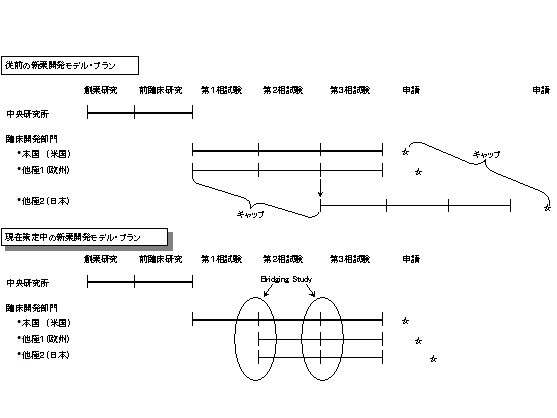
図8.外資系企業における日本市場参入のためのプラン
米国本社における、前臨床試験結果や臨床試験結果をお互いに有効利用し、他極においても積極的に利用しようという試みである。
米国本社では、グローバル同時上市までのスピードを最優先として考えており、そのためには、申請を成功させるための高度に集中された活動が求められることになる。
また日本法人においては、日本の要求をグローバル・プランに反映するためにグローバル・チームと緊密な連携を維持し、当局との折衝に関しての窓口を行っている。
そしてグローバル・スタディで得られた情報を日本でのローカル・スタディに最大限活用することを計画中である。
外資系企業における、日本法人の役割は下記のようなものがあげられる。
- 申請までに必要となるスタディの実施
- 担当製品に関する開発プランの策定と実施
- 担当製品の最適ライフ・プラン策定のための、ローカルな要求・専門知識をグローバル・チームに伝達
- ローカル市場を最大化するための計画策定
- グローバル・スタディの成果の最大活用
- マーケティング部門との緊密な連携で、ローカル・マーケティング・プランの策定
これらはまだ計画段階に過ぎないが、今後数多くのトライアルによって、問題点が出され、解決が行われていくものと思われる。
想定される課題としては、
- グローバルチームの力量に依存する事項が多い
- スピード最優先と各国個別要求対応との兼ね合い
- 国際標準への対応が急がれる
- ITによる情報共有の仕組み作り
- コミュニケーション・オーバーヘッド
- 言語の違い
などがあげられる。
特に言語の問題は、どの会社においても共通の課題であり、国内における日本語の文書作成と、レビュのための翻訳版の作成が必要である。
またITに関しては、国際間での標準を作成するとともに、グローバルチームとローカルチームの協業を支援するために積極的に導入を図るべきである。(図9)
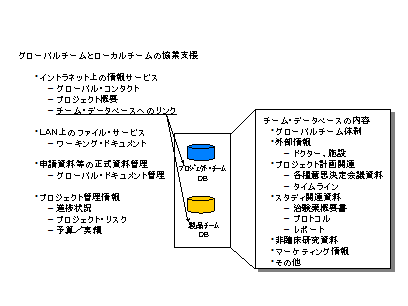
図9 グローバルチームとローカルチームのITによる協業支援
4.国産製薬会社におけるグローバル展開の障壁
4.1. 最初のグローバリゼーション
先に見てきたように、外資の製薬会社のグローバル化は欧米を範囲にとどめている。
つまり、日本を含めた真の意味での日米欧三極でのグローバリゼーションを成し遂げた企業はいまだかつてない。
しかしながら、日本に本社を持つ製薬企業にとって、グローバル化はすなわち日米欧三極でのビジネスを立ち上げるということに相違ない。
要するに、最初に日本と欧米のオペレーションの統合をはからねばならないのは、日本企業なのである。
外資系企業が日本に積極的に進出することよりもまして困難が予想される。
第一に、これまでの国内の需要にのみ対応してきた薬剤の研究開発も、これからは世界に通用する薬剤を開発していく必要性があるということである。
またグローバルなオペレーションを側面から援助するITの導入も不可欠である。
しかしながら、これまで自社開発をしてきたアプリケーションから、グローバルスタンダードへの移行には数々の問題点が存在する。
4.2.欧米先行型開発
国民皆保険という非常に恵まれた環境にあっては、日本の臨床試験は遅々として進まないのが現状である。患者を集めるのも大変な苦労が付きまとう。つまり、患者にとって望んで無償の治験薬を試用しなくとも、保険による医療がほとんどの場合適用できるからである。
また、臨床試験の受け皿である医療機関や医師も非常に不足している。
大手の製薬会社は、日本での臨床試験をあきらめ、欧米先行型に切り替えているところが増えてきた。
臨床試験を海外で行うことの課題は次のようなものが考えられる。
- 非臨床試験は日本で行っており、海外への技術文書移管を行わなければならない
- 英語によるドキュメントを作成しなければならない
- デファクトスタンダードであるITの利用
- 海外に十分な開発部隊を持たない会社にとっては、CRO(Contract Research Organization)を利用することになる
- データベースの標準化を図り、データの受け渡しを迅速に行わなければならない
- 日本国内での開発に比べて、金がかかる
以上の事柄について、個々に検討してみたい。
4.2.1.技術文書移管
これまでの非臨床試験においては、ほとんどの研究員がグローバルを意識しないで研究報告書を書いてきた。
今後は、欧米でも受け入れられる基準での技術文書の作成と品質保証が要求される。
また多くの場合、文書は紙ベースで作成され、電子化は行われていない。
莫大な数量になる技術文書を効率的に管理し、検索等を容易にすることが求められる。
4.2.2.英語によるドキュメント作成
最もグローバルスタンダードに準拠しなければならないのは、言語であろう。
最近、数社の大手製薬会社では、研究員に最初から英文で研究報告書を書かせているところも見受けられるようになった。
しかしながら一部を除いて、ほとんどの場合英文による文書作成は、品質に問題が発生する。さらにドキュメントのレビュに対しても不安が残る。
また、ある会社でのインタビュによると、日本語での文書作成から英文での文書作成に移行したことによって、1.7倍の時間がかかることになったという結果がある。
やはり英文の文書作成は、専門家による翻訳が良いのではないだろうか。
ただし、研究員が英語で記述すべきものは、文書のタイトルと要旨であろうと考える。
海外から技術文書を検索するにあたっては、まずタイトルを見ることから始まる。
また要旨がきちんと整理された形でかかれており、必要なキーワードを十分に含んでおれば、検索も容易となる。
海外の担当者は、要旨を読めば大体の内容が把握できるはずである。
本文に関しては、要求に応じて、優先度の高いものから順次翻訳を行えばよいであろう。
4.2.3.デファクトスタンダードであるITの利用
多くの会社ではこれまで自作のアプリケーションを利用してきた。特に汎用機を利用した各種データの管理方法は各社各様である。
今後世界に共通してITを利用するためには、既にデファクトスタンダードとなったアプリケーションを選択しなければならない。
その際の課題として、
- 現行のデータを移行しなければならない
- デファクトスタンダードとなったアプリケーションが日本語をサポートしているとは限らない。
という大きな二つの問題に直面することになる。
4.2.4.CRO(Contract Research Organization)の利用
CROを利用することは、他の会社と共同で臨床試験を行うということである。この際に重要なことは、日本本社のITポリシーに沿った形でデータおよび各種資料の受け渡しがなされなければならない。
多くの場合、CROに任せきったり、CROの言うとおりにデータベースを作成することが見受けられる。これでは、グローバルに統一したオペレーションが出来るどころか、スタディごとの整合性についても問題が発生してしますことになる。
5.製薬業界におけるグローバルスタンダードを意識したITの導入プロジェクト
5.1.言語の問題
日本企業が直面する最初の障害は、何と言っても言語である。
世界で幅広く採用されているアプリケーションが、実は日本語の対応版がなく、日本では採用できないケースがある。
また例えMS-Wordのように日本語に対応しているアプリケーションを利用する際にも、注意が必要である。ある製薬会社のIT担当者は、日本語MS-Wordは、同じ名前であっても、まったくMS-Wordとは別製品であるとまで言っている。このことについては、次項以降において論じる。
更に、ドキュメントなどに使用するキャラクターについても細心の注意が必要となる。
例えば、日本語ではダブルバイトの文字を常用しているが、英文ドキュメントを作成する際には、これが障害となる。ダブルバイトを含むドキュメントを、英語版のMS-Wordで開くと、文字が見えないという現象が起こるのである。
何もキャラクターの問題は、日本から外国への一方向のものではない。筆者はかつてデンマークへ出張することになった際、電子メールによって空港からホテルまでの距離を質問したことがあった。そこで返ってきた返事によると、タクシーを利用して’?Hours’かかるとの事であった。おそらく文字化けしたものであろうと考えたのだが、はたして’?’に入る数字がどのくらいなのか想像もつかなかった。
実際に現地でタクシーに乗ってみると、なんと15分で到着したのである。
つまり化けて見えなかった文字は1/4というキャラクターだったのである。
当然日本には、こんなキャラクターはないのであるが、ヨーロッパで使用されているキーボードには、1/2と1/4という文字が並んでいるのである。
逆の例では、’¥’をあげることが出来る。これを英語環境で見た際には、バックスラッシュになることは良く知られていることである。
5.2.Word文書による英文ドキュメント作成時の注意点
日本語MS-Wordを使用して、英語の文書を作成し、外国等において英語MS-Word で開いて読む場合、正常に読むことができない場合がある。
それは、日本語MS-Wordと英語MS-Wordの機能等に整合性がないためである。
システムに登録や相手に送付する前に、英語MS-Wordと整合性のある状態にする必要がある。
また、文書作成時には日本語MS-Word、英語MS-Wordの特長をよく理解して、機能を使い分ける必要がある。
ダブルバイトが含まれている文書を、英語MS-Wordで開こうとすると、以下のメッセージが表示される。
ダブルバイト等整合性のない内容が含まれているまま、英語MS-Wordで文書を開くと、以下の現象が発生する。
- ダブルバイト文字がブランクとなり、表示されなくなる
- 日本語MS-Wordのグラフィック機能で書かれた図が消える
- 日本語MS-Wordの表作成機能で書かれた表の線等が正常に表示されない
日本語MS-Wordで文書を作成中に、ダブルバイト文字が含まれる可能性のある場所は、主に以下の通りである。
- 本文
- ブックマーク
- キャプション
- フィールドコード
- 注釈
- 脚注/文末脚注
- ヘッダ/フッタ
更に、以下の場所にダブルバイトが含まれている可能性、および英語MS-Wordでサポートしていない機能を使用する可能性があり、あらかじめ英語文書への使用は避けるか、十分チェックを行う必要がある。
- 文書プロパティ
- リンクされているファイルや図
- ユーザー定義のスタイル
- 縦書き文字
- 幅広文字
- 表の斜め罫線
- 数式エディタで作成されたオブジェクト
またダブルバイトで入力される可能性のある文字は以下のものがあり、細心の注意が必要である。
- (
- )
- ・
- ±
- ≧
- ≦
- <
- >
- %
- :
5.3.日本語MS-Word文書にGraphicsを描画する場合の注意
文書作成時、日本語MS-Wordの描画ツールを用いて図を書く場合、これらの図は日本語MS-WordのGraphics Layerに置かれるため、Graphics Layerのない英語MS-Wordで文書を開くと、グラフィックスの表示が消えるという現象が発生する。
これを解決するには、以下の2つの方法がある。
- 描画ツールで書かれたGraphics Layerの図を、別の方法でText Layerに書き変える
- 当該文書をPDFに変換する
5.4.PDFファイルの利用
日本語MS-Wordで作成した英語文書の中で、英語MS-Wordで読むと非表示となってしまうような図を作成せざるを得なかったり、表の体裁がくずれてしまうような表を書かざるを得ない場合は、PDFファイルに変換する方法をとることができる。
ただしPDFファイルの特長としては下記の事項があげられる。
- 編集は不可能である
- オリジナル文書よりも容量(byte数)が小さくなる
- Annotation(コメント)を入力できる
6.おわりに
本文中に何度か述べてきたことであるが、欧米の企業からみて、日本の文化には独特でユニークなものが多々ある。
世の中はグローバリゼーションやらグローバルスタンダードで一色であるが、本当の意味での国際化とは、各国の特長を取り入れながらうまく融合していくことではないだろうか。
日本の製薬会社も世界に出て行かないといけないことを力説したが、やはり販売の主流は日本国内であることに代わりはないのである。
グローバリゼーションに関するコンサルテーションを担当する際、日本企業の特長を生かした上で、世界に通用するようなシステムを考えて欲しいと依頼を受けたことも多々ある。
また外資の企業では、本社と日本法人の間で、コミュニケーションをあえて避けているのではないかと思われるような状況にたびたび遭遇することもある。
どうせ言っても本社は聞き入れないだろうとか、どうせ理解できないだろうからと言ったように最初から諦めてかかっているようにさえ見える。
大事なことは、日本の要求を本社に正しく伝え、日米欧でのハーモナイズされたシステムの運用を図ることである。
日米欧の3極の一端を担う日本なのであるから、何も卑屈になることはないと思う。
欧米とのコミュニケーションを避けたとき、それはグローバル化に背を向けたことに等しいといえる。
(2000年8月執筆)


