設計移管とは ㈱イーコンプライアンス
設計移管とは
設計移管は「FDA 21CRF Part820 Quality System Regulation」の「Subpart C§820.30(h) Design transfer」で規定されている。
(h) 設計移管 各製造業者は手順を確立し維持し、機器設計が製造仕様書に正確に移し換えられることを保証する こと。 |
設計移管とは、設計バリデーションにより妥当性が確認された最終の設計アウトプットを製造の仕様書に正確に移管する作業である。すなわち、設計移管フェーズにおいては、妥当性確認のなされた設計アウトプットを製造プロセスおよび製造仕様に落とし込む。
設計移管においては、事前に設計開発文書および製造方法に関する文書の徹底的な評価を行う必要がある。すなわち、技術的な適切性、設計の安全性および信頼性を確立しなければならない。
医療機器が意図された使用および要求に合致していることを確かめるために、文書化された製造プロセスや仕様書と設計アウトプットを比較するレビュを実施すること。
製造仕様を確立するために用いられるサポーティングドキュメント等は、設計移管時にレビュ・承認すること。
完成医療機器は設計開発段階で定められ、承認された仕様書、原材料、コンポーネントを用いて製造されなければならない。製造段階では、通常の製造において用いられるあらかじめ計画されたものと同一または同様(合理的な理由がある場合に限る)の設備を用いなければならない。
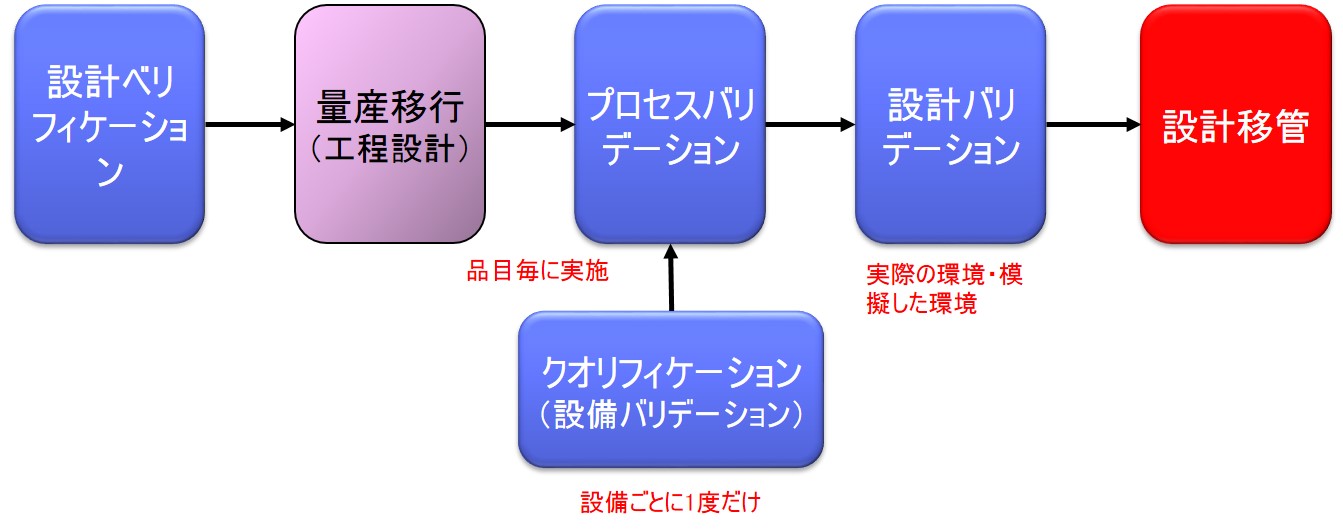
設計移管と量産移行を混同しているケースを多く見かけるが、これは間違いであるので注意すること。
- 参考
21 CFR Part820 Quality System Regulation, FDA 1997
Design Control Guidance For Medical Device Manufacturers, FDA 11 March,1997
FDA査察対応設計管理手順書サンプル
イーコンプライアンスでは、FDAが要求する設計管理に対応した、規程、手順書、様式のサンプルを販売しています。
ぜひご購入をご検討下さい。
【関連記事】
★ リスクマネジメント
★ CAPA
★ 21 CFR Part 11
★ FDA関連情報
★ CSV関連情報
★ Part11関連情報
★ ER/ES指針関連情報
★ EDC関連情報
★ ドキュメント管理システム導入の考え方
用語集






