設計バリデーション(設計の妥当性確認)とは ㈱イーコンプライアンス
設計バリデーション(設計の妥当性確認)とは
設計バリデーションは「FDA 21CRF Part820 Quality System Regulation」の「Subpart C§820.30(g) Design validation」で規定されている。
(g) 設計の妥当性確認 各製造業者は、手順を確立し維持し、設計の妥当性確認をすること。設計の妥当性確認は、定義さ れた運用手順の下で、初期製造のユニット、ロット、またはバッチまたはそれと同様な対象に対し て行う。 |
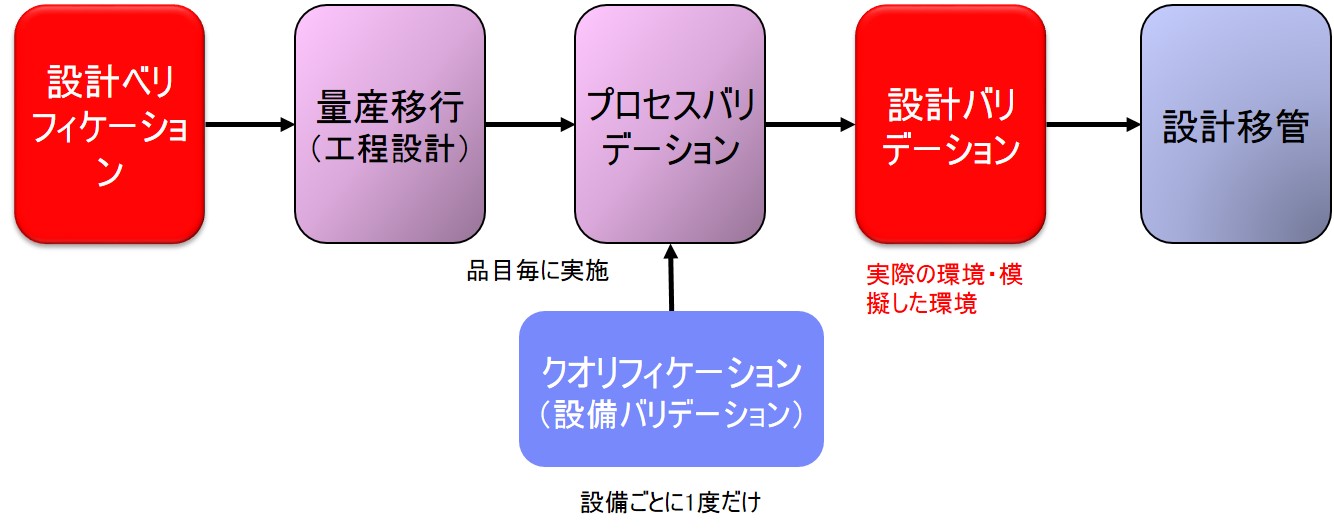
- 参考
21 CFR Part820 Quality System Regulation, FDA 1997
Design Control Guidance For Medical Device Manufacturers, FDA 11 March,1997
FDA査察対応設計管理手順書サンプル
イーコンプライアンスでは、FDAが要求する設計管理に対応した、規程、手順書、様式のサンプルを販売しています。
ぜひご購入をご検討下さい。
【関連記事】
★ リスクマネジメント
★ CAPA
★ 21 CFR Part 11
★ FDA関連情報
★ CSV関連情報
★ Part11関連情報
★ ER/ES指針関連情報
★ EDC関連情報
★ ドキュメント管理システム導入の考え方
用語集






