UDI偵偮偄偰 噴僀乕僐儞僾儔僀傾儞僗
UDI乮屄懱幆暿丄Unique Device Identification乯
UDI偲偼
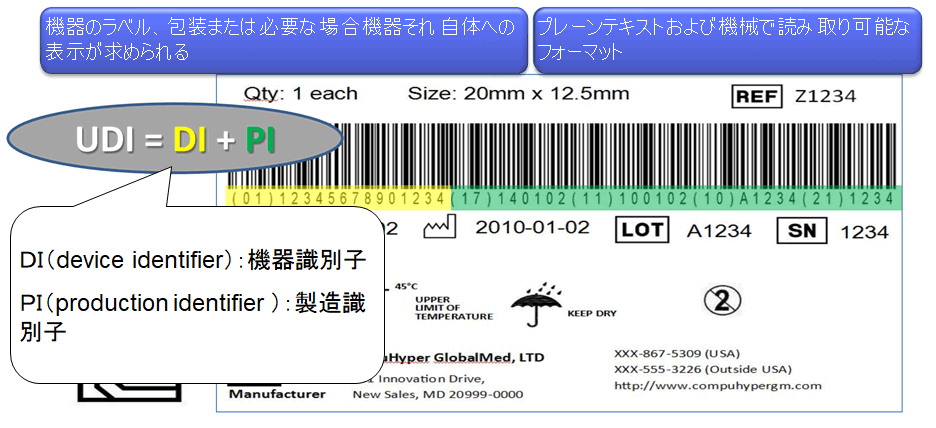
- UDI丗Unique Device Identifier乮婡婍屌桳幆暿巕乯
婡婍偺棳捠傗巊梡傪偲偍偟偰揔愗偵婡婍傪幆暿偡傞幆暿巕偺偙偲傪偄偆丅UDI 偼埲壓偺傕偺偐傜側傞丗- 婡婍偺幆暿巕(a device identifier)—UDI 偺媊柋偐偮掕傔傜傟偨晹暘偱偁傝婡婍偺摿掕偺僶乕僕儑儞傑偨偼儌僨儖偍傛傃摉奩婡婍偺儔儀儔乕傪摿掕偡傞傕偺
- 惢憿幆暿巕(a production identifier)—UDI 偺忦審晅偒偺丄壜曄偺晹暘偱偁傝丄婡婍偺儔儀儖偵娷傔傜傟偨応崌偵埲壓偺偆偪偺 1 偮埲忋傪摿掕偡傞傕偺
- 婡婍偑惢憿偝傟偨儘僢僩傑偨偼僶僢僠
- 摿掕偺婡婍偺僔儕傾儖僫儞僶乕
- 摿掕偺婡婍偺桳岠婜尷
- 摿掕偺婡婍偑惢憿偝傟偨擔晅
- 婡婍偲偟偰婯惂傪庴偗傞 HCT/P 偮偄偰偼丄偙偺復偺 1271.290(c)偱梫媮偝傟傞屄暿偺幆暿僐乕僪
- 婡婍偺幆暿巕(a device identifier)—UDI 偺媊柋偐偮掕傔傜傟偨晹暘偱偁傝婡婍偺摿掕偺僶乕僕儑儞傑偨偼儌僨儖偍傛傃摉奩婡婍偺儔儀儔乕傪摿掕偡傞傕偺
- 2013擭9寧偵惂掕偝傟偨FDA偺儔儀儕儞僌偵娭偡傞怴婯懃
- 2014擭9寧傛傝抜奒揑偵摫擖奐巒
倀俢俬婯惂偺栚揑
- 棳捠丒巊梡偺娫偵婡婍傪揔愗偵摿掕偱偒傞僔僗僥儉偺妋棫
- 恦懍偐偮惓妋側婡婍偺摿掕傪梕堈偵偡傞
- 婡婍偵娭偡傞廳梫側忣曬傊偺傾僋僙僗傪壜擻偵偡傞
- 揹巕揑側僿儖僗儗僐乕僪丄僋儕僯僇儖僀儞僼僅儊乕僔儑儞僔僗僥儉丄儗僙僾僩僨乕僞僜乕僗偍傛傃儗僕僗僩儕偵婡婍偺巊梡傪暥彂壔偡傞偨傔偺 昗弨揑偱偐偮柧妋側曽朄傪採嫙偡傞
倀俢俬婯惂懳墳僞僀儉儔僀儞

UDI梫媮偺Compliance Dates
2013擭9寧24擔偵FDA偼UDI偵娭偡傞Final Rule傪敪弌偟偨丅
埲壓偵UDI梫媮偺Compliance Dates傪婰嵹偡傞丅
Complianece Date |
梫媮帠崁 |
2014擭9寧24擔 |
Class嘨婡婍偺儔儀儖偍傛傃僷僢働乕僕丄側傜傃偵Public Health Service Act(PHS Act)偵傛傝擣壜偝傟偨婡婍偼UDI傪旛偊側偗傟偽側傜側偄丅§801.20 |
2015擭9寧24擔 |
杽傔崬傒宆婡婍丄life-supporting婡婍偍傛傃life-sustaining婡婍偺儔儀儖偍傛傃僷僢働乕僕偼UDI傪旛偊側偗傟偽側傜側偄丅§801.20 |
2016擭9寧24擔 |
UDI儔儀儖昞帵偺媮傔傜傟傞Class嘨婡婍偼丄暋悢夞巊梡偟丄奺巊梡偺慜偵嵞張棟傪峴偆応崌丄婡婍偦傟帺懱偵塱媣揑側報偲偟偰偺UDI傪旛偊側偗傟偽側傜側偄丅§801.45 |
2018擭9寧24擔 |
UDI儔儀儖昞帵偺媮傔傜傟傞Class嘦婡婍偼丄暋悢夞巊梡偟丄奺巊梡偺慜偵嵞張棟傪峴偆応崌丄婡婍偦傟帺懱偵塱媣揑側報偲偟偰偺UDI傪旛偊側偗傟偽側傜側偄丅§801.45 |
2020擭9寧24擔 |
UDI儔儀儖昞帵偺媮傔傜傟傞Class嘥婡婍偍傛傃Class嘥丄嘦丄嘨偺偄偢傟偵傕暘椶偝傟偰偄側偄婡婍偼丄暋悢夞巊梡偟丄奺巊梡偺慜偵嵞張棟傪峴偆応崌丄婡婍偦傟帺懱偵塱媣揑側報偲偟偰偺UDI傪旛偊側偗傟偽側傜側偄丅§801.45 |
弌揟丗Unique Device Identification (UDI)






