過去のお知らせ
過去のお知らせ
コンサルティング価格変更のお知らせ
イーコンプライアンスは、2020年4月よりコンサルティングサービスの価格を、一部改定することとなりました。
改定後の価格についてはこちらをご参照ください。
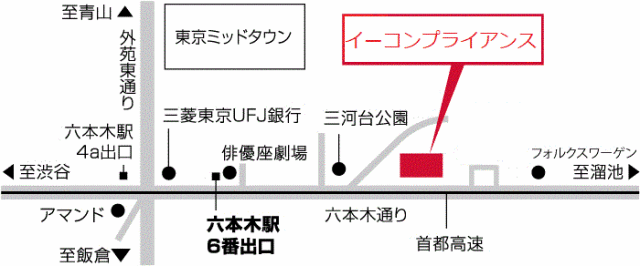
本社移転のお知らせ
当社が入居しておりましたテナントビル「六本木ハイツ」において3/23(月)に火災が発生し、
当社オフィスも罹災いたしました。
これにより本社を下記住所に移転いたしましたのでお知らせいたします。
〒106-0032
東京都港区六本木4-9-2 俳優座ビル703
電話番号:050-3733-8134
FAX:03-6745-8626
新刊書籍販売開始のお知らせ
ーデータインテグリティ規程・手順書テンプレート付きー
当局要求をふまえたデータインテグリティ手順書作成の要点
【データインテグリティ規程&手順書サンプル無料ダウンロード!!】
【発刊日】2020年3月30日
【著 者】株式会社イーコンプライアンス 代表取締役 村山 浩一
≪ここがポイント≫
データインテグリティの要求事項を適切に反映した手順書の具体的な作成方法を学ぶ
【実際の「規程」&「手順書」サンプルデータ付き】
企業側で使いやすく、かつ当局要求をふまえた手順書作成のためには!
作成にあたりまず何をすればいいのか?実際に作成するための流れを、巻末サンプルをふまえ具体的に解説。
「読みやすく」「理解しやすく」「改訂しやすい」手順書作成のポイントがわかる!
FDA査察対応のスペシャリストである筆者より、本当に必要なデータインテグリティ対応を教えます
数多くの医薬品・医療機器企業のコンサルティング・FDA査察対応を行い、
非常に豊富な経験・実績を持つ筆者の観点より、 机上の空論だけでない、実業務に活かせるデータインテグリティ対応のポイントを解説!
最終目標であるデータインテグリティSOP作成のために、データインテグリティ要件を根本から理解できる
・ データインテグリティが重要視されるようになった訳とは ?
・ データインテグリティが脅かされる要因及びその対応
・ 企業にとってデータインテグリティの実施が困難な理由とは?
・ どんな企業がFDA査察官に安心を与えるのか
・ データインテグリティ対応の実際のステップや各局面の留意事項
お申し込みはこちら。
無料パンフレットのダウンロードはこちら。
資料およびビデオのダウンロードご提供のお知らせ
2020年3月4日に実施いたしました、改正GMP省令に対応するためのデータインテグリティセミナーおよび改正GMP省令に対応するためのCAPAセミナーの資料とビデオを公開いたします。
下記のURLからダウンロードをしてください。
※ビデオは容量が大きくダウンロードにお時間がかかることがございます。
【改正GMP省令に対応するためのデータインテグリティセミナー】
資料はこちら。
ビデオはこちら。
【改正GMP省令に対応するためのCAPAセミナー】
資料はこちら。
ビデオはこちら
ISO-14971:2007年版⇔2019年版対比表ご提供のお知らせ
イーコンプライアンスでは、ISO-14971:2007年版とISO-14971:2019年版の対比表を作成いたしました。
どこが修正になったのかを一目して確認できるようにいたしました。
ただし、ISO-14971には著作権があるため、ISO-14971:2007年版とISO-14971:2019年版(現状では英語版のみ)を購入されている方のみを対象とさせて頂きます。
また配布方法はLINE経由のみとさせて頂きます。
入手ご希望の方は、こちらをご参照ください。
キャッシュレス還元

この度、イーコンプライアンスはキャッシュレス消費者還元事業者として登録されました。
10月1日以降にクレジットカードで決済いただくと5%還元されます。
※還元額の上限はクレジットカード会社毎に決められています。
【ポイント還元制度とは】
対象店舗でクレジットカード/デビットカード・電子マネー・QRコード等を使って代金を支払うとポイント還元が受けられる制度です。
詳細はこちら
日経産業新聞掲載
7月31日(水)の日経産業新聞の紙面広告に、医療機器産業参入、医療機器薬事申請支援に関する記事が掲載されました。
またWebメディア「KJCBIZ」も併せて是非ご覧ください。
?KJCBIZ:2019年7月31日(水)Web版はこちら
【FDAデータインテグリティに関するガイダンス発行】 (2018年12月12日)
FDAは2018年12月に「Data Integrity and Compliance With Drug CGMP Questions and Answers Guidance for Industry」(データインテグリティのガイダンス(Q&A))を最終化し発行しました。
詳しくはこちら。
対訳版はこちら。
データインテグリティSOP作成セミナー(サンプルSOP配布)はこちら。
無料イーラーニングはこちら。
【日本版GDPガイドライン発出】
2018年12月28日付で日本版GDPガイドラインが発出されました。
事務連絡およびGDPガイドラインはこちら
【医薬品cGMPに関するFDAガイダンス公開】
FDAガイダンス「医薬品cGMPにおける品質システムからのアプローチ(Quality Systems Approach to Pharmaceutical CGMP Regulations)」の邦訳版を公開しました。
詳しくはこちら
【FDA査察において指摘ゼロを連続達成(2/15)】
イーコンプライアンスでは、FDA査察対応において通算7度目となるNAI(No Action Indicated:指摘なし)を達成いたしました。
【インターフェックス大阪 講演のお知らせ(2/22)】
イーコンプライアンス 代表取締役の村山 浩一は、2019年2月22日のインターフェックス大阪において、「GMP省令改正に向けた準備と留意点 ~データインテグリティー手順書の作成~」と題した講演を行うことになりました。
詳しくはこちら。

カナダでは、2017年、2018年を移行期間として、 2019年1月1日以降、これまでのCMDCASからMDSAPに完全移行します。
そして2019年よりMDSAPの認証のみ受け入れます。 カナダで医療機器を販売する企業の場合、MDSAPを必ず受審・認証を受けなければなりません。
MDSAPは一度の調査で5か国の規制要件への適合性が調査されます。 すなわち、5か国共通の要求事項に対する重大な不備が発見された場合、調査機関から5か国に対し当該不適合が報告されてしまうことになります。 場合によってはFDAからWarning Letterが送られてくることもあり得ます。
for cause査察が行われる等の可能性もあります。
また、初年度にグレード4、5に等級付けされた不適合を次回監査までに是正できていない場合、加点ルールに従ってさらに高い不適合グレードを付与されてしまいます。 つまり、1年目はかろうじて監査をクリアしたとしても、次回調査で当局報告レベルに達する不適合判定を得てしまう可能性があります。
MDSAPはCompanion Documentをベースにプロセスリンケージに着目した調査が行われます。 Companion Document:13485:2016をベースにし各国の要求事項を追加したMDSAP調査手順書です。 Companion DocumentはISO13485の箇条をそのまま記載するのではなく、各要求事項の遵守により達成されるべき状態に製造業者のQMSがあることを確認することを求めています。
FDAのQSITに近い査察手順書です。
すなわち、ISO13485等の要求事項の本質を製造業者が理解し、自社のQMSに落とし込んでいるかが調査されます。さらに、プロセスリンケージに沿った調査が行われるため、QMS内のプロセスのつながりを適切に理解しないことには、調査にタイムリーかつ適切に対応することは難しいでしょう。 MDSAP受審前に、規制要求事項の本質の理解および自社のQMSの理解、自社QMSの不備事項の事前の発見、改善が肝心といえます。
本MDSAP適合性チェックリストは医療機器各社がMDSAPを受審する前の自己点検用に作成したものです。 ぜひご活用ください。
本社移転のお知らせ(2018/5/7)
株式会社イーコンプライアンスは2018年5月7日より、本社を下記住所に移転することとなりました。
〒106-0032
東京都港区六本木4-1-16
六本木ハイツ706号室
Tel 03-6441-3364
Fax 03-6441-3365
詳しくは こちら。
イーコンプレスメールマガジンMD(Medical Device)第1号発行(4/2)
株式会社イーコンプレスでは、医療機器企業向けのメールマガジンを4月から毎週月曜日に発行することとなりました。 本日第1号を発行いたしました。詳しくは こちら。
イーコンプレスメールマガジンと伴わせてご愛読くださいますよう、宜しくお願い申し上げます。 イーコンプレスメールマガジンMD(Medical Device)の配信ご希望の方は、下記よりご登録ください。
【IEC-62304対応】ソフトウェア開発規程・手順書ひな形販売開始
(サンプルはこちら [規程]・[手順書])
本邦において、2017年11月より、IEC 62304(医療機器ソフトウェア ‐ ソフトウェアライフサイクルプロセス)が、実質的な規制要件となりました。
IEC 62304は、2006年5月に発行され、日本では2012年にJIS化(JIS T 2304)されました。 米国FDAにおいても、2008年7月にRecognized Consensus Standardと認定されています。
IEC 62304は「医療機器ソフトウェア」の開発と保守に関するプロセスを規定しています。
日本以外でも、欧州・北米・中国などにおいて、医療機器申請時にIEC 62304に基づくソフトウェア開発の証拠が必要です。
つまり、IEC 62304に従って、「医療機器ソフトウェア」を開発しなければ、国内外においてソフトウェアを搭載した医療機器(単体プログラムを含む)を販売することができません。
しかしながら、 IEC 62304は非常に難解です。 具体的に、どのような対応をとればよいのでしょうか。
一般にIEC 62304のようなプロセス規格は各社によってまちまちの解釈が行われ、手順書の内容が大きく異なってしまいます。
・IEC 62304を読んでも、対応すべき内容や方法が分からない。
・IEC 62304を読んでも、どこまでやるべきなのかの範囲が分からない。
・IEC 62304の詳細の内容が、不明なまま文書構築を行っている。
などといった疑問点が多く寄せられます。 本「IEC 62304対応規程・手順書ひな形」を導入いただくことによってIEC 62304に準拠したQMSを効率的・効果的に作成することができます。
セミナーライブ配信スタート(2017年10月20日以降)
株式会社イーコンプライアンスは株式会社ファシオ(東京都新宿区、佐々木 英明社長)と提携し、 2017年10月20日以降にイーコンプライアンスが実施するセミナーをインターネットを介してライブで配信することとなりました。
受講者は、パソコンやスマートフォンのブラウザから専用サイトで簡単に受講していただけます。
詳しくはこちら。
《会場でのご参加もお持ち申し上げております。》
CFDA(中国医薬品食品局)共同セミナー発表報告
株式会社イーコンプライアンス 代表取締役 村山 浩一は、2017年3月8日に中華人民共和国 泰州市で開催されたCFDA(中国医薬品食品局)との共同セミナーで発表を行いました。
詳しくはこちら。
セミナー申込に関するキャンセル規定変更のお知らせ
【キャンセルポリシー】
お申込み後、ご都合が悪くなった場合は代理の方のご出席も可能です。
やむなくキャンセルされる場合は、下記のキャンセル規定にて承ります。
<キャンセル規定>
開催日から逆算(営業日:土日・祝祭日等を除く)いたしまして、
・開催7日前以前でのキャンセル: キャンセル料はいただきません
・開催6~3日前でのキャンセル: 受講料の70%
・開催2日前~当日でのキャンセル・欠席: 受講料の100%
※受講料入金後での7日前以前のキャンセルについて、返金の手続きが発生した場合の振込手数料はお客様負担とさせていただきます。
ユーザビリティ翻訳版掲載のお知らせ
FDAは2016年2月3日にApplying Human Factors and Usability Engineering to Optimize Medical Device Design
(ヒュンマンファクターとユーザビリティの適用)と題するガイダンスを発行しました。これは、2000年7月18日付“Medical Device Use-Safety: Incorporating Human Factors Engineering into Risk Management”に置き換わるものです。
邦訳版はこちら
2名同時申込みで1名分無料特別キャンペーン 終了のお知らせ
株式会社イーコンプライアンスでは、2年間にわたりまして、当社セミナーにおいて「2名同時申込みで1名分無料特別キャンペーン」を実施して参りました。
お陰様を持ちまして、これまで多くの皆様にセミナーにお越しくださいました。
このたび、10月度のセミナーをもちまして「2名同時申込みで1名分無料特別キャンペーン」を終了させて頂く事となりました。
今後ともイーコンプライアンスの各種セミナーをご愛用頂きますようお願い申し上げます。
【セミナーご参加特典】
イーコンプライアンスのセミナー、書籍をご購入いただけましたらポイントがたまります。
お支払いは、銀行振り込み、クレジットカード決済、コンビニ支払いなど各種の方法が選べます。
FDA査察において指摘ゼロ記録を更新
株式会社イーコンプライアンスでは、2016年8月22日から8月26日まで実施された、医療機器企業のFDA査察において指摘ゼロ(NAI:No Action Indicated)を達成いたしました。
当社コンサルテーションによるFDA査察指摘ゼロの連勝記録を更新いたしました。
イーコンプライアンスでは、FDA査察対応をご支援しております。詳しくはこちらをご参照ください。
FDA査察に関するイーラーニングはこちら
FDA査察に関する情報が満載のメルマガ登録はこちら
QMS 調査におけるISO 13485 の改訂の取扱いについて
厚生労働省医薬・生活衛生局監視指導・麻薬対策課は、平成28年7月29日付で「QMS調査におけるISO 13485 の改訂の取扱いについて」と題した事務連絡を発出いたしました。
2016年2月にISO-13485:2016が改定されましたが、QMS省令は当面の間はISO-13485:2003と整合させることとなっています。
しかしながら、ISO-13485:2016は2003に比べて厳格化(FDA QSRにほぼ整合)したものであることから、ISO-13485:2016を遵守していればQMS省令を遵守したこととみなす旨が記載されています。
QMS省令とISO-13485:2016の用語の比較はこちら。
イーコンプライアンス本社移転のおしらせ
このたび、株式会社イーコンプライアンスの本社を2016年6月1日に移転いたしました。
今後とも弊社の各種サービスをご愛顧賜りますようお願い申し上げます。
詳しくはこちら
移転先 〒140-0004
東京都品川区南品川3-2-4 ドメイン品川シーサイドビル 1階
電話:03-5461-9538
FAX:03-5460-0955
コンサルティング料金改定のおしらせ
イーコンプライアンスでは、2016年4月1日よりコンサルティング料金を改定させて頂くこととなりました。
コンサルティング料金表はこちら。
従前は、半日または1 日単位とさせて頂いておりましたが、今後は1 時間単位とさせて頂きます。
これにより、よりきめ細やかなサービスのご提供ができるものと考えております。
今後とも当社のサービスをご用命頂きますようお願い申し上げます。
【無料配布】 イーコンプライアンス通信 第57号発刊のお知らせ
「イーコンプライアンス通信」第57号を発刊いたしました。
ご希望の方には無料でお送りします。
【内容】
・データインテグリティについて
お申込みは、こちら
バックナンバーは、こちら
新刊書籍発刊のお知らせ
【要点をわかりやすく学ぶ】
PIC/S GMP Annex15適格性評価とバリデーション
【発刊日】2015年10月29日
【著 者】株式会社イーコンプライアンス 代表取締役 村山 浩一
≪ここがポイント≫
現在のバリデーション手順からどこを変更し、どのように対応していくべきか
・Annex15が求める製薬企業と供給者の責任範囲とそれぞれが対応すべき要件範囲とは
・リスクペースドアプローチをどのようにバリデーションに結びつけ、実践するのか
・Annex15要求事項に沿うプロセスバリデーションの実施
・現行のAnnex15と改訂版を対比し、変更点を明確に提示しながらわかりやすく解説
PIC/S-GMP Annex 15「Qualification and Validation」の改定版が発出されました。 施行は2015年10月からとなりました。改定版では2013年1月1日から改定されたAnnex 11 (コンピュ一タ化システム)Annex 13(治験薬)との整合性や、ICH Q8、Q9、Q10 との整合性を考慮されました。 Annex 15の改定により、いったい何が変わるのでしょうか。 また製薬企業や構造設備等の供給者にとってどのようなインパクトがあるのでしょうか。 当書籍では、難解なAnnex15をわかりやすく解説します。
お申し込みはこちら。
PIC/S GDPガイド翻訳版掲載のお知らせ
2014年6月から施行されたPIC/S GDPガイド(Good Distribution Practice(実践流通規範))の邦訳版を掲載いたしました。 どうぞご利用ください。
新刊書籍発刊のお知らせ
【要点をわかりやすく学ぶ】
製薬・医療機器企業におけるリスクマネジメント
【発刊日】2015年8月28日
【著 者】株式会社イーコンプライアンス 代表取締役 村山 浩一
≪ここがポイント≫医薬品・医療機器それぞれのリスクマネジメントを初心者にも解りやすく解説!
・リスクマネジメントの全体像の把握と個々のアセスメント手法の理解
・リスクベースドアプローチとは??FDAが求めるリスク管理と査察対応
・医薬品・医療機器のリスクマネジメントの差異と各特徴・留意点
・「リスク」と「ハザード」の違いと各特定方法、マネジメント手法
筆者が常日頃から思ってきたことは、医薬品(ICH-Q9)や医療機器(ISO-14971)に関するリスクマネジメントのセミナーや書籍が皆目ないということである。
その理由は定かではないが、おそらくいずれも非常に難解であることと、網羅的に実践した経験者が圧倒的に少ないことに起因するのではないかと思われる。
本書では、医薬品と医療機器のリスクマネジメントを両方取り扱う。
医薬品と医療機器では、リスクマネジメントに関する対応方法や対象が異なる。
しかしながらそのプロセスはほぼ同じである。
医薬品と医療機器で、どのようにリスクマネジメントの実施に差異があるかということにも言及した。本書では、難解なリスクマネジメントについて、できる限りわかりやすく執筆したつもりである。
本書が、読者諸兄のリスクマネジメントへの理解を深める一助となり、より安全な医薬品・医療機器を世の中に出せることを願っている。
(はじめに 抜粋)
お申し込みはこちら。
PIC/S GMP Annex 15: Qualification and Validationの発出
2015年4月1日付でPIC/S GMP Annex 15: Qualification and Validationが発出されました。
これは、2015年3月30日付で発出されたEU GMP Annex 15: Qualification and Validationと一部の修正を除き全く同じ内容です。
いずれもは2015年10月1日施行予定です。
改定版においてはICH Q8、Q9、Q10、Q11との整合が図られました。
また、Quality by Design(QbD)やリスク評価、品質システム等の要素も組み込まれています。
・PIC/S GMP Annex15改定版の日本語訳(対訳)はこちら。
・EU GMP Annex15改定版の日本語訳(対訳)はこちら。
・Annex15改定版の解説セミナーはこちら。
(音声入りのため容量が大きいので、ダウンロード時にご注意ください。)
新QMS省令対応QMS(ひな形)販売およびコンサルテーションのお知らせ
2014年11月25日から、薬事法が一部改正されました。
これにより、旧来の「薬事法」という名称から、「医薬品、医療機器等の品質、有効性および安全性の確保等に関する法律」(薬機法)という名称に変更されました。
「体制省令」に基づく組織体制の整備をはじめ、新QMS省令に準拠した手順書類の確立、また製造業の登録や、既存品目の新法移行手続き(記載整備)、そして新法下における更新QMS調査に向けた準備など、医療機器の製造販売業者、製造業者には各種の対応が求められることになります。
薬機法の施行に伴い、製造販売業の許可要件であるGQP省令が抜本的に見直され、QMS省令に包括されました。つまり、これまでのQMS省令は、製造業者にのみ適用されてきましたが、
新QMS省令は製造販売業者にも適用されることとなりました。
株式会社イーコンプライアンスでは、新QMS省令に則った「QMS」のひな形(サンプル)の販売およびコンサルテーションを実施しております。
詳しくは、こちら
QMS省令およびGCTP省令に関するQ&Aの発出(3/17更新)
厚生労働省により、「医療機器及び体外診断用医薬品の製造管理及び品質管理の基準等に係る質疑応答集(Q&A)について(その2)(平成27年3月13日付け薬食監麻発0313第8号厚生労働省医薬食品局監視指導・麻薬対策課長通知)」
および「再生医療等製品の製造管理及び品質管理の基準等に関する質疑応答集(Q&A)について(平成27年3月17日付け薬食監麻発0317第1号厚生労働省医薬食品局監視指導・麻薬対策課長通知)」 が発出されました。
FDAが医療機器データシステムに関するガイダンスを発行(2/6更新)
Today the FDA posted a final guidance document on medical device data systems (MDDS).
This guidance confirms our intention to not enforce regulations for technologies that receive, transmit, store, or display data from medical devices.
We hope that finalization of this policy will create an impetus for the development of new technologies to better use and display this data.
We also updated the Mobile Medical Apps guidance to be consistent with the MDDS final guidance.
【大阪オフィス閉鎖のお知らせ】
株式会社イーコンプライアンス 大阪オフィス(大阪市中央区北浜東)は、2015年5月31日をもちまして閉鎖いたしました。
日本と韓国がPIC/Sに加盟(5/19)
5/15、16にローマで開催されていたPIC/S総会において、日本と韓国が2014年7月1日付でPIC/Sに加盟することを決定しました。
日本は、厚生労働省がPMDAおよび都道府県を代表して、第45番目の加盟規制当局となった。韓国は、食品医薬品安全局(Food and Drug Safety (MFDS))が第46番目の加盟規制当局となった。 日本も韓国もPIC/Sへの加盟申請をそれぞれ2012年3月9日、2012年4月10日に提出していた。
詳しくは、こちら
「GMP省令の取扱いについて」通知発出(8/30)
厚生労働省は、「医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令の取扱いについて」及び意見募集の結果を通知しました。
詳しくは、こちら
厚労省 審査管理課が「治験関連文書における電磁的記録の活用に関する基本的考え方について」を発出(7/1)
厚生労働省医薬食品局審査管理課は、製薬企業および医療機関に向けた「治験関連文書における電磁的記録の活用に関する基本的考え方について」という事務連絡を発出いたしました。
本事務連絡は、治験依頼者等、治験審査委員会、実施医療機関の長及び治験責任医師との間で授受される治験関連文書を電磁的記録として保存等することに関する基本的考え方を示したものです。
これにより、治験手続きの効率化に寄与することを目的としています。
詳しくは、こちら
【コンピュータ化システム適正管理ガイドライン対応】『システム台帳管理システム』発売のお知らせ(7/1)
~査察時に提示が必要なシステム台帳を安全に管理します~
貴社ではまだシステム台帳をMS-Excelで管理していませんか?
Excelの管理ではシステムのバージョン管理や、システムの変更管理が大変です。
またファイルが突然消えてしまうといったリスクも考えられます。
本システム台帳管理システムは、監査証跡を自動的に残します。
複雑なインストーレーションも不要です。
★ システム台帳の作成・管理が義務付けられています。
★ コンピュータ化システムが一元管理できます。
★ コンピュータ化システムの導入・変更・廃棄が管理できます。
★ MS-Excelへの出力も可能です。
★ 廃棄したシステムも一覧表示可能です。
★ 査察時に必要な条件で抽出した台帳を印刷することができます。
★ 21 CFR Part 11で要求されている監査証跡機能も搭載しています。
詳しくはこちら
厚生労働省が「GMP施行通知」および「バリデーション基準」等の改定を発表(6/14)
厚生労働省は、2013年06月14日に「「医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令の取扱いについて」に関する意見募集について」と題したパブリックコメントの募集を開始いたしました。パブリックコメントは、7月14日まで受付けられています。
これはPIC/S GMPとの国際整合性を明確にするための、今後のGMP省令の取扱いに関する通知に関する意見を募集するものです。
本通知(案)では、
1. 品質リスクマネジメントの活用
2. 製品品質の照査におけるコンピュータ(電子記録)の利用
3. GMP施行通知の改正
4. バリデーション基準の見直し
などが大きな改正点です。
詳しくは、こちら
「GMP施行通知」および「バリデーション基準」等の改定について詳しく勉強したい方は、こちら
PIC/S対応のSOPs等を共同作成したい方は、こちら
CSV研究会再開のお知らせ(7/1)
これまでシステム信頼性保証研究会(CSV研究会)は35回実施してまいりました。
その研究内容は、厚労省から平成22年秋に発出された「コンピュータ化システム適正管理ガイドライン」に対応するためのSOP作成が主目的でした。
それらの活動も一段落しましたので、本年度はCSV研究会の開催を休止しておりましたが、厚労省からGMP施行通知の改定等が発表されましたので、8月5日より再開することといたします。
本研究会では、以下の活動を予定しています。
・CSV研究会で作成された適正管理ガイドライン対応CSVのSOPをPIC/S GMP Annex11に合わせて改訂
・ER/ESのSOPをPIC/S GMP Annex11に合わせて改訂
・新バリデーション基準の理解と対応手順書の作成
・ITインフラの適格性評価SOPの作成
・品質リスクマネジメント手順書の検討
・電子記録による製品品質の照査に関する手順書の検討
・供給者管理手順書の検討
皆様の積極的なご参加をお待ちしております。
詳しくは、こちら
PMDAが「EDC管理シート」を発表(3/27)
独立行政法人医薬品医療機器総合機構(以下、PMDA)は、平成25年3月27日に「EDCを利用した治験、製造販売後臨床試験及び使用成績調査に係る適合性調査等の実施手続きについて」と題する通知を発出しました。
本通知はPMDAが、EDC(Electronic Data Capture)を利用した治験、製造販売後臨床試験及び使用成績調査(以下、治験等)に関する適合性調査を効果的かつ効率的に実施するため、調査事前提出資料として製薬企業等にEDCを利用した業務がどのように行われているかをまとめた「EDC管理シート」の作成、提出を求めるものです。
原則として平成25年10月1日以降に実施される適合性調査から、事前提出資料として「EDC管理シート」の提出が求められます。
詳しくは、こちら
EDC管理シートは、こちら
EDC管理シートについて詳しく勉強したい方は、こちら
EDC管理シート対応のSOPが必要な方は、こちら
【新刊本】『システムの適格性確認および回顧的バリデーションの具体的実施方法』発刊のお知らせ(1/20)
株式会社イーコンプレスでは、
【厚労省新ガイドライン対応シリーズ②】
『システムの適格性確認および回顧的バリデーションの具体的実施方法』
~どういう順序でどこまで実施するべきか~
を発刊いたしました。
システム適格性調査報告書のテンプレート付です。
ぜひお買い求めください。
新刊本のお知らせ
3極規制要件をふまえた
コンピュータ化システムのカテゴリ別CSV実践方法
~製造用コンピュータ化システム編 ・ ラボ(分析機器)編 ・ ITアプリケーション編~
【発刊】 2012年8月24日
【体裁】B5判並製本 約200頁
【監修】(株)イーコンプライアンス 代表取締役 村山 浩一1
【価格(税込)】 39,900円(送料は当社負担)
【ISBNコード】 ISBN978-4-86428-054-9
【Cコード】C3047
<著者>
村山 浩一 氏 (株)イーコンプライアンス 代表取締役
横井 昭彦 氏 ITエンジニアリング(株) P-ITソリューション統括製薬ソリューション部
杉本 隆之 氏 (株)ソアズ 代表取締役【元 エーザイ(株)】
QCラボにおける「コンピュータ化システム適正管理GL」対応イーラーニング公開のお知らせ(5/3)
2012年3月14日に総評会館で講演致しました。【無料セミナー】QCラボにおける「コンピュータ化システム適正管理GL」対応をイーラーニングで無料公開いたしました。
ぜひ復習にご活用ください。
QCラボにおける「コンピュータ化システム適正管理GL」対応
(2012年3月14日収録:2:00)
第1章新ガイドラインとGMP査察
第2章電子化のリスク
第3章電子生データとは
第4章新ガイドラインとQCラボ
第5章21 CFR Part 11とQCラボ
第6章ANNEX 11とQCラボ
韓国KFDAがPIC/Sへの加盟申請を提出(4/10)
PIC/Sは、4/17にホームページにおいて、韓国KFDA(the Korea Food and Drug Administration)がGMP調査の国際的枠組み「医薬品査察協定及び医薬品査察協同スキーム」(PIC/S)への加盟申請を行ったことを明らかにしました。
PIC/Sは、この申請受け入れのため、ジュネーブで2012年5月7月~8日に行われる次のPIC/S委員会において審査官(ラポータ)を選任する予定です。
詳しくはこちら
厚労省がPIC/Sへの加盟申請を提出(3/9)
PIC/Sは、3/26にホームページにおいて、厚労省がGMP調査の国際的枠組み「医薬品査察協定及び医薬品査察協同スキーム」(PIC/S)への加盟申請を行ったことを明らかにしました。以下、邦訳です。
日本、PIC/Sに加盟申請
ジュネーブ 2012年3月26日
2012年3月9日、日本の厚生労働省は、医薬品医療機器総合機構(PMDA)及び日本の都道府県を代表し、厚労省名でPIC/Sへの加盟を申請した。
PIC/Sは、この申請受け入れのため、ジュネーブで2012年5月7月~8日に行われる次のPIC/S委員会において審査官(ラポータ)を選任する予定である。
詳しくはこちら
「Guidance for Industry Providing Regulatory Submissions in Electronic Format — Standardized Study Data DRAFT GUIDANCE」発表(2/17)
FDA (CBER, CDER and CDRH)は、2/17(金)に「Guidance for Industry Providing Regulatory Submissions in Electronic Format — Standardized Study Data」と題したドラフトガイダンスを発行いたしました。
現時点ではまだドラフトガイダンスですが、生物製剤、医薬品および放射線学的健康に関するFDAセンター(CBER、CDERとCDRH)は、標準化電子形式による臨床データの申請を大幅に早める見込みとなるガイダンスをリリースしました。
本テーマに関する一連のガイダンスの一つである本ガイダンスは、人間及び動物の両方の臨床データに対応するすべての施設において、また理解できる申請形式に対する、最初のものです。
本ガイダンスは、他と同様、電子申請の対象について、スポンサーに当局の勧告や期待を伝えるものではなく、申請の技術的側面の詳細に対する仕様及び基準を参照するように役立てるものです。
規制の専門家の特別な関心事は、セクションAにある。標準化された研究データ(4ページ)の計画及び提供については、開発のIND/ IDE段階中に当局に連絡する研究データあるいはデータ管理プランをスポンサーに作成するよう指示するものです。
この計画には、スポンサーの利用目的のデータの基準にしたがった研究計画のリスト及び説明を含める必要があります。
ドラフトガイダンスではまた、臨床データの実装計画の場所、レガシー•データのコンバージョン、管理された専門用語、レビュア・ガイドの使用及びIND一般的な治験計画を提案しています。
さらに、バイオメトリクス•グループに決定的な重要性となるデータのバリデーション及び相互運用性についての広範囲な議論があります。
詳しくはこちら
【新サービス】LIMS導入コンサルテーション
株式会社イーコンプライアンスでは、LIMS(Laboratory Information management System)の導入コンサルテーションを開始いたしました。
2011年1月13日にEU GMP ANNEX 11 Computerised Systemsが改定されました。
ANNEX 11は、FDAのPart11に対する回答書という位置付けで発行されています。
特に、LIMSを用いた出荷判定に関しては、かなり厳しい要件が盛り込まれました。
貴社のLIMSは、ANNEX 11等の最新の規制要件を満たすことができるでしょうか。
またこれからLIMSを導入しようとしている企業では、何を基準にシステムを選定すればいいのでしょうか。
日本製のLIMSのほとんどは最新の規制要件を満たせていません。
イーコンプライアンスでは、どのLIMSを選択すべきか、またバリデーションやPart11対応等の規制要件遵守のためのコンサルテーションをご提供いたします。
詳細はこちら
【無料配布】イーコンプライアンス通信第33号発刊のお知らせ(3/14)
イーコンプライアンスでは、ミニコミ誌「イーコンプライアンス通信」第33号を発刊いたしました。
「イーコンプライアンス通信」では、最新のコンピュータ化システムに関する規制動向や、CSV文書の作成方法、ER/ES指針の解説などを掲載いたします。
ご希望の方には無料でお送りいたします。お申込み、バックナンバーはこちら
システム台帳の整備方法イーラーニング公開のお知らせ(2/17)
2012年1月17日に総評会館で講演致しました。「【無料セミナー】システム台帳の整備方法」をイーラーニングで無料公開いたしました。ぜひ復習にご活用ください。
システム台帳の整備方法(2012年1月17日収録:2:00)
テキストファイルはこちら
第1章 新ガイドライン概要
第2章 新ガイドラインとGMP査察
第3章 システム台帳とは
第4章 システム台帳のスコープ
第5章 システム台帳の整備方法
第6章 既存システムの適格性の確認方法
回顧的バリデーションの実施方法イーラーニング公開のお知らせ(3/9)
2012年2月15日に総評会館で講演致しました。
「【無料セミナー】回顧的バリデーションの実施方法」をイーラーニングで無料公開いたしました。
ぜひ復習にご活用ください。
回顧的バリデーションの実施方法(2012年2月15日収録:2:00)
テキストファイルはこちら
第1章 回顧的バリデーションの概要
第2章 既存システムの適格性の確認方法
第3章 再バリデーションの実施要領
【ビデオ配信】「第22回 CSV研究会」公開のお知らせ(3/22)
2012年2月15日に総評会館で開催いたしました、「第22回 CSV研究会」の模様をイーラーングニ化いたしました。 復習等にご活用ください。
詳細はこちら
「PIC/SのGMPガイドライン活用のための考え方について」発出(2/1)
厚生労働省医薬食品局監視指導・麻薬対策課は、2/1に「PIC/SのGMPガイドライン活用のための考え方について」と題した事務連絡を発出いたしました。
また同時に、質疑応答集(Q&A)および「PIC/SのGMPガイドラインを活用する際の考え方(案)
に関する意見募集の結果について」(パブリックコメントへの回答)も発出いたしました。「PIC/SのGMPガイドラインを活用する際の考え方(案)に関する意見募集について」と題した、パブリックコメントの募集は平成23年11月4日より12月5日までの間募集されていました。
詳しくはこちら
PIC/SのGMPガイドライン活用のためのパブリックコメント募集開始(11/4)
厚生労働省医薬食品局監視指導・麻薬対策課は、11月4日より「PIC/SのGMPガイドラインを活用する際の考え方(案)に関する意見募集について」と題してパブリックコメントの募集を行っています。
締め切りは、12月5日です。
詳しくはこちら
【eCTD書籍セット発売】のお知らせ
2011年11月7日発刊を記念して『eCTD申請 -ここまで身近になったeCTD申請-』と2009年11月30日発刊の『eCTD (基礎から応用まで)- eCTD の解説,実務,医薬品開発における eCTD の現状と課題-』をセットで販売いたします。
セット価格合計30,000円のところ、21,000円(税込)にて特別販売致します。
詳細とご購入はこちら
【新刊発売】eCTD申請 -ここまで身近になったeCTD申請-
2011年11月7日発刊
価格18,000円(税込)
ISBN 978-4-905321-03-3 A4 156頁
詳細とご購入はこちら
【改定版】厚労省ER/ES指針対応実施の手引き発売のお知らせ
2008年に発売した、厚労省ER/ES指針対応実施の手引きの改定版を9/20に発行いたしました。
ISBN 978-4-905321-01-9 A4 90頁 定価12,000円(税込)
詳細はこちら
「最新のCSV動向および21 Part 11も視野に入れたFDA査察対応方法」セミナー(12/8)
~講師が実際に対応したFDA査察事例に学ぶ~
- 価格 :47,250 円(税込)
日時 :2011年12 月8日(木)10:30 ~ 16:30(10:00 開場)
場所 : 東京流通センター(TRC)第4 会議室
講師 :有限会社ソアズ 取締役 杉本 隆之 氏
- 元エーザイ株式会社
- ISPE GAMP Japan Forum リーダー
- 製剤機械技術学会
- トレーサビリティ委員会 委員
詳細とお申込みはこちら
【出版記念講演会】
「eCTD 申請 -ここまで身近になったeCTD 申請-」セミナー(12/7)
価格 :36,750 円(税込)
日時 :2011年12 月7 日(水)10:30 ~ 16:30(10:00 開場)
場所 : 東京流通センター(TRC)第4 会議室
講師 :エーザイ株式会社 比留間 良一 氏
プラネットファーマソリューションズ 深澤 秀通 氏
※特典といたしまして、セミナーにご参加された方全員に新刊本「eCTD 申請 -ここまで身近になったeCTD 申請-」(定価18,000 円)を無料で贈呈いたします。
詳細とお申込みはこちら
コンピュータ化システム適正管理ガイドラインセミナーのお知らせ
来る10/21にTH企画セミナーセンター主催による
「コンピュータ化システム適正管理ガイドライン」の対応
~新ガイドラインの特徴、課題と問題点、準備作業について~
と題したセミナーをイーコンプライアンス 代表取締役 村山 浩一が担当いたします。 詳しくはこちら
新刊発売のお知らせ
2008年に発売開始した、GAMP 5, FDA, ANNEX 11 に対応した「コンピュータバリデーション実施の手引き」の改定版を発行いたしました。
ISBN 978-4-905321-00-2 A4 132頁 定価12,000円(税込)
好評発売中!
詳細はこちら
【ビデオ配信】「厚労省新ガイドラインに適合したCSVの実施方法」セミナー(7/22)
2011年7月11日に総評会館で開催いたしました、「厚労省新ガイドラインに適合したCSVの実施方法」のセミナーの模様をイーラーニング化いたしました。
無料でご視聴いただけます、復習等にご活用ください。
「厚労省新ガイドラインに適合したCSVの実施方法」
テキストPDFファイルはこちら
【収録内容】
第1章 新ガイドラインとGMP査察
第2章 GMPとバリデーション
第3章 適格性評価とは
第4章 新ガイドライン概要
第5章 PIC/Sと新ガイドライン
第6章 新ガイドライン対応の優先順位
第7章 QCラボにおける新ガイドライン対応
第8章 LIMSと出荷判定
コンサルティングアシスタント採用のお知らせ
株式会社イーコンプライアンスでは、業務拡大に伴い、新規スタッフを募集しています。
コンサルタントに同行し、ITに関する知識を使ってお客様先で打合せを行います。英語が堪能な方は、外資系企業を担当してTV会議参加や海外出張などグローバルに活躍して頂きます。
オフィスでは、コンサルティングに必要な資料等の作成をお願いします。
詳しくはこちらからお問合せ下さい。
セミナーのお知らせ
【株式会社プロス主催】CSV新ガイドライン対応リスクアセスメント実践セミナー
株式会社プロスでは、2011年6月17日(金)~2011年9月30日(金)まで
製造、品質、システム 各部門の責任者および担当者を対象にした「CSV新ガイドライン対応リスクアセスメント実践セミナー」を開催しております。
ぜひご参加ください。詳細はこちら
RxLogix社との業務提携
株式会社イーコンプライアンスとRxLogix社(本社:カリフォルニア州、Raj More社長)は、業務提携することで合意しました。
RxLogix社は、グローバル安全性情報管理(Pharmacovigilance:PV)業務に造詣が深く、ORACLE社が全世界的に販売しているArgus Safetyシステムを中心に、システム構築、ビジネスプロセス構築等の支援をしています。
これまで海外の安全性情報管理システムは、日本当局の要件を完全にサポートしていませんでした。そのため、日本独自のシステムを導入せざるを得ませんでした。
また日本を含めたグローバルの安全性情報管理に関するコンサルテーションを実施できるコンサルティングチームも希少でした。
しかしながら、今後はArgusシステムを導入し、当社およびRxLogix社のコンサルティングを採用いただくことによって、グローバルに真のSingle Safety Databaseの構築が行えます。
株式会社イーコンプライアンスは、日本におけるパートナーとして、現行システムからのデータ移行も含めて、グローバル安全性情報管理システム構築のご支援を行います。
English
FDAがガイドライン ドラフト版を発行
FDAは、2011年1月6日「Electronic Source Documentation in Clinical Investigations」(ドラフト)を発行いたしました。
パブリックコメントの募集が90日間行われています。
詳しくはこちら
翻訳はこちらをご参照ください。
ANNEX 11改定版発行(1/13)
ECA(Eupopean Compliance Agency)は、2011年1月13日「ANNEX 11 Computerised Systems」の改定版を発行いたしました。
詳しくはこちら
対応期限は、2011年6月30日となりました。
日本語訳はこちら
新刊発売のお知らせ(12/8)
【厚労省新ガイドライン対応シリーズ①】
医薬品・医薬部外品製造販売業者における「コンピュータ化システム適正管理ガイドライン」対応準備の手引き~適用日までに何を準備しなければならないか~
詳しくはこちら
A4版 定価¥12,000-(税込)
ISBN:978-4-904512-08-1
本書籍は、電子ファイル(pdf)でも販売しております。
ただし、ご購入はクレジットカード払いに限ります。
商品のダウンロードは、こちらからお願いします。
厚労省新ガイドライン発出(10/21)
厚生労働省は、2010年10月21日「医薬品・医薬部外品製造販売業者等におけるコンピュータ化システム適正管理ガイドライン」を発出しました。
適用開始は、平成24年4月1日からとなりました。詳しくはこちら
同時に、事務連絡として質疑応答集(Q & A)も発行されました。詳しくはこちら
本ガイドラインは、2010年7月16日に案が発表され、同8月20日までパブリックコメントが募集されました。パブリックコメントは、31通394件寄せられたとのことです。
なおパブリックコメントの回答は、ここで参照できます。
また、同ガイドライン(案)からの変更点については、こちらをご参照ください。
株式会社イーコンプレス設立のお知らせ
2010年9月16日にセミナー、書籍等の企画・販売専門会社として株式会社イーコンプレスを設立いたしました。
これまでイーコンプライアンスで販売をしておりましたセミナー、書籍等はイーコンプレスのホームページでご案内いたします。
詳しくはこちらをご覧ください。
書籍販売提携に関するお知らせ(8/1)
株式会社イーコンプライアンスとサイエンス&テクノロジー株式会社(東京都港区浜松町2-7-14 福嶋 邦彦社長)は、株式会社イーコンプライアンスがS&T社が主催するセミナーの一部販売に加えて、S&T社が発行する書籍の一部を販売することで業務提携することに合意いたしました。
株式会社イーコンプライアンスのホームページからお申込み頂け、クレジットカード払い、コンビニ決済、Edy、銀行振込などの各種決済方法をお選びいただけます。
会員の方にはポイントを差し上げます。また貯まったポイントを次回以降のお買い物にご利用いただけます。
FDAがPart11査察開始を宣言(7/8)
2010年7月8日、FDAは21 CFR Part 11の査察開始(再開)をアナウンスしました。
詳しくはこちら
翻訳は、こちらをご参照ください。
FDAのPart11査察に関する考え方は、こちらをご参照ください。
製薬・医療機器企業におけるリスクマネジメント
【発刊日】2015年8月28日
【著 者】株式会社イーコンプライアンス 代表取締役 村山 浩一
≪ここがポイント≫医薬品・医療機器それぞれのリスクマネジメントを初心者にも解りやすく解説! ・リスクマネジメントの全体像の把握と個々のアセスメント手法の理解 ・リスクベースドアプローチとは??FDAが求めるリスク管理と査察対応 ・医薬品・医療機器のリスクマネジメントの差異と各特徴・留意点 ・「リスク」と「ハザード」の違いと各特定方法、マネジメント手法
筆者が常日頃から思ってきたことは、医薬品(ICH-Q9)や医療機器(ISO-14971)に関するリスクマネジメントのセミナーや書籍が皆目ないということである。 その理由は定かではないが、おそらくいずれも非常に難解であることと、網羅的に実践した経験者が圧倒的に少ないことに起因するのではないかと思われる。 本書では、医薬品と医療機器のリスクマネジメントを両方取り扱う。 医薬品と医療機器では、リスクマネジメントに関する対応方法や対象が異なる。 しかしながらそのプロセスはほぼ同じである。 医薬品と医療機器で、どのようにリスクマネジメントの実施に差異があるかということにも言及した。本書では、難解なリスクマネジメントについて、できる限りわかりやすく執筆したつもりである。 本書が、読者諸兄のリスクマネジメントへの理解を深める一助となり、より安全な医薬品・医療機器を世の中に出せることを願っている。 (はじめに 抜粋)
お申し込みはこちら。
PIC/S GMP Annex 15: Qualification and Validationの発出
2015年4月1日付でPIC/S GMP Annex 15: Qualification and Validationが発出されました。 これは、2015年3月30日付で発出されたEU GMP Annex 15: Qualification and Validationと一部の修正を除き全く同じ内容です。 いずれもは2015年10月1日施行予定です。 改定版においてはICH Q8、Q9、Q10、Q11との整合が図られました。 また、Quality by Design(QbD)やリスク評価、品質システム等の要素も組み込まれています。 ・PIC/S GMP Annex15改定版の日本語訳(対訳)はこちら。 ・EU GMP Annex15改定版の日本語訳(対訳)はこちら。 ・Annex15改定版の解説セミナーはこちら。 (音声入りのため容量が大きいので、ダウンロード時にご注意ください。)
新QMS省令対応QMS(ひな形)販売およびコンサルテーションのお知らせ
2014年11月25日から、薬事法が一部改正されました。
これにより、旧来の「薬事法」という名称から、「医薬品、医療機器等の品質、有効性および安全性の確保等に関する法律」(薬機法)という名称に変更されました。
「体制省令」に基づく組織体制の整備をはじめ、新QMS省令に準拠した手順書類の確立、また製造業の登録や、既存品目の新法移行手続き(記載整備)、そして新法下における更新QMS調査に向けた準備など、医療機器の製造販売業者、製造業者には各種の対応が求められることになります。
薬機法の施行に伴い、製造販売業の許可要件であるGQP省令が抜本的に見直され、QMS省令に包括されました。つまり、これまでのQMS省令は、製造業者にのみ適用されてきましたが、
新QMS省令は製造販売業者にも適用されることとなりました。
株式会社イーコンプライアンスでは、新QMS省令に則った「QMS」のひな形(サンプル)の販売およびコンサルテーションを実施しております。
詳しくは、こちら
QMS省令およびGCTP省令に関するQ&Aの発出(3/17更新)
厚生労働省により、「医療機器及び体外診断用医薬品の製造管理及び品質管理の基準等に係る質疑応答集(Q&A)について(その2)(平成27年3月13日付け薬食監麻発0313第8号厚生労働省医薬食品局監視指導・麻薬対策課長通知)」
および「再生医療等製品の製造管理及び品質管理の基準等に関する質疑応答集(Q&A)について(平成27年3月17日付け薬食監麻発0317第1号厚生労働省医薬食品局監視指導・麻薬対策課長通知)」 が発出されました。
FDAが医療機器データシステムに関するガイダンスを発行(2/6更新)
Today the FDA posted a final guidance document on medical device data systems (MDDS). This guidance confirms our intention to not enforce regulations for technologies that receive, transmit, store, or display data from medical devices. We hope that finalization of this policy will create an impetus for the development of new technologies to better use and display this data. We also updated the Mobile Medical Apps guidance to be consistent with the MDDS final guidance.
【大阪オフィス閉鎖のお知らせ】
株式会社イーコンプライアンス 大阪オフィス(大阪市中央区北浜東)は、2015年5月31日をもちまして閉鎖いたしました。
日本と韓国がPIC/Sに加盟(5/19)
5/15、16にローマで開催されていたPIC/S総会において、日本と韓国が2014年7月1日付でPIC/Sに加盟することを決定しました。
日本は、厚生労働省がPMDAおよび都道府県を代表して、第45番目の加盟規制当局となった。韓国は、食品医薬品安全局(Food and Drug Safety (MFDS))が第46番目の加盟規制当局となった。 日本も韓国もPIC/Sへの加盟申請をそれぞれ2012年3月9日、2012年4月10日に提出していた。
詳しくは、こちら
「GMP省令の取扱いについて」通知発出(8/30)
厚生労働省は、「医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令の取扱いについて」及び意見募集の結果を通知しました。
詳しくは、こちら
厚労省 審査管理課が「治験関連文書における電磁的記録の活用に関する基本的考え方について」を発出(7/1)
厚生労働省医薬食品局審査管理課は、製薬企業および医療機関に向けた「治験関連文書における電磁的記録の活用に関する基本的考え方について」という事務連絡を発出いたしました。
本事務連絡は、治験依頼者等、治験審査委員会、実施医療機関の長及び治験責任医師との間で授受される治験関連文書を電磁的記録として保存等することに関する基本的考え方を示したものです。
これにより、治験手続きの効率化に寄与することを目的としています。
詳しくは、こちら
【コンピュータ化システム適正管理ガイドライン対応】『システム台帳管理システム』発売のお知らせ(7/1)
~査察時に提示が必要なシステム台帳を安全に管理します~
貴社ではまだシステム台帳をMS-Excelで管理していませんか?
Excelの管理ではシステムのバージョン管理や、システムの変更管理が大変です。
またファイルが突然消えてしまうといったリスクも考えられます。
本システム台帳管理システムは、監査証跡を自動的に残します。
複雑なインストーレーションも不要です。
★ システム台帳の作成・管理が義務付けられています。
★ コンピュータ化システムが一元管理できます。
★ コンピュータ化システムの導入・変更・廃棄が管理できます。
★ MS-Excelへの出力も可能です。
★ 廃棄したシステムも一覧表示可能です。
★ 査察時に必要な条件で抽出した台帳を印刷することができます。
★ 21 CFR Part 11で要求されている監査証跡機能も搭載しています。
詳しくはこちら
厚生労働省が「GMP施行通知」および「バリデーション基準」等の改定を発表(6/14)
厚生労働省は、2013年06月14日に「「医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令の取扱いについて」に関する意見募集について」と題したパブリックコメントの募集を開始いたしました。パブリックコメントは、7月14日まで受付けられています。
これはPIC/S GMPとの国際整合性を明確にするための、今後のGMP省令の取扱いに関する通知に関する意見を募集するものです。
本通知(案)では、
1. 品質リスクマネジメントの活用
2. 製品品質の照査におけるコンピュータ(電子記録)の利用
3. GMP施行通知の改正
4. バリデーション基準の見直し
などが大きな改正点です。
詳しくは、こちら
「GMP施行通知」および「バリデーション基準」等の改定について詳しく勉強したい方は、こちら
PIC/S対応のSOPs等を共同作成したい方は、こちら
CSV研究会再開のお知らせ(7/1)
これまでシステム信頼性保証研究会(CSV研究会)は35回実施してまいりました。
その研究内容は、厚労省から平成22年秋に発出された「コンピュータ化システム適正管理ガイドライン」に対応するためのSOP作成が主目的でした。
それらの活動も一段落しましたので、本年度はCSV研究会の開催を休止しておりましたが、厚労省からGMP施行通知の改定等が発表されましたので、8月5日より再開することといたします。
本研究会では、以下の活動を予定しています。
・CSV研究会で作成された適正管理ガイドライン対応CSVのSOPをPIC/S GMP Annex11に合わせて改訂
・ER/ESのSOPをPIC/S GMP Annex11に合わせて改訂
・新バリデーション基準の理解と対応手順書の作成
・ITインフラの適格性評価SOPの作成
・品質リスクマネジメント手順書の検討
・電子記録による製品品質の照査に関する手順書の検討
・供給者管理手順書の検討
皆様の積極的なご参加をお待ちしております。
詳しくは、こちら
PMDAが「EDC管理シート」を発表(3/27)
独立行政法人医薬品医療機器総合機構(以下、PMDA)は、平成25年3月27日に「EDCを利用した治験、製造販売後臨床試験及び使用成績調査に係る適合性調査等の実施手続きについて」と題する通知を発出しました。
本通知はPMDAが、EDC(Electronic Data Capture)を利用した治験、製造販売後臨床試験及び使用成績調査(以下、治験等)に関する適合性調査を効果的かつ効率的に実施するため、調査事前提出資料として製薬企業等にEDCを利用した業務がどのように行われているかをまとめた「EDC管理シート」の作成、提出を求めるものです。
原則として平成25年10月1日以降に実施される適合性調査から、事前提出資料として「EDC管理シート」の提出が求められます。
詳しくは、こちら
EDC管理シートは、こちら
EDC管理シートについて詳しく勉強したい方は、こちら
EDC管理シート対応のSOPが必要な方は、こちら
【新刊本】『システムの適格性確認および回顧的バリデーションの具体的実施方法』発刊のお知らせ(1/20)
株式会社イーコンプレスでは、
【厚労省新ガイドライン対応シリーズ②】
『システムの適格性確認および回顧的バリデーションの具体的実施方法』
~どういう順序でどこまで実施するべきか~
を発刊いたしました。
システム適格性調査報告書のテンプレート付です。
ぜひお買い求めください。
新刊本のお知らせ
3極規制要件をふまえた
コンピュータ化システムのカテゴリ別CSV実践方法
~製造用コンピュータ化システム編 ・ ラボ(分析機器)編 ・ ITアプリケーション編~
【発刊】 2012年8月24日
【体裁】B5判並製本 約200頁
【監修】(株)イーコンプライアンス 代表取締役 村山 浩一1
【価格(税込)】 39,900円(送料は当社負担)
【ISBNコード】 ISBN978-4-86428-054-9
【Cコード】C3047
<著者>
村山 浩一 氏 (株)イーコンプライアンス 代表取締役
横井 昭彦 氏 ITエンジニアリング(株) P-ITソリューション統括製薬ソリューション部
杉本 隆之 氏 (株)ソアズ 代表取締役【元 エーザイ(株)】
QCラボにおける「コンピュータ化システム適正管理GL」対応イーラーニング公開のお知らせ(5/3)
2012年3月14日に総評会館で講演致しました。【無料セミナー】QCラボにおける「コンピュータ化システム適正管理GL」対応をイーラーニングで無料公開いたしました。
ぜひ復習にご活用ください。
QCラボにおける「コンピュータ化システム適正管理GL」対応
(2012年3月14日収録:2:00)
第1章新ガイドラインとGMP査察
第2章電子化のリスク
第3章電子生データとは
第4章新ガイドラインとQCラボ
第5章21 CFR Part 11とQCラボ
第6章ANNEX 11とQCラボ
韓国KFDAがPIC/Sへの加盟申請を提出(4/10)
PIC/Sは、4/17にホームページにおいて、韓国KFDA(the Korea Food and Drug Administration)がGMP調査の国際的枠組み「医薬品査察協定及び医薬品査察協同スキーム」(PIC/S)への加盟申請を行ったことを明らかにしました。
PIC/Sは、この申請受け入れのため、ジュネーブで2012年5月7月~8日に行われる次のPIC/S委員会において審査官(ラポータ)を選任する予定です。
詳しくはこちら
厚労省がPIC/Sへの加盟申請を提出(3/9)
PIC/Sは、3/26にホームページにおいて、厚労省がGMP調査の国際的枠組み「医薬品査察協定及び医薬品査察協同スキーム」(PIC/S)への加盟申請を行ったことを明らかにしました。以下、邦訳です。
日本、PIC/Sに加盟申請
ジュネーブ 2012年3月26日
2012年3月9日、日本の厚生労働省は、医薬品医療機器総合機構(PMDA)及び日本の都道府県を代表し、厚労省名でPIC/Sへの加盟を申請した。
PIC/Sは、この申請受け入れのため、ジュネーブで2012年5月7月~8日に行われる次のPIC/S委員会において審査官(ラポータ)を選任する予定である。
詳しくはこちら
「Guidance for Industry Providing Regulatory Submissions in Electronic Format — Standardized Study Data DRAFT GUIDANCE」発表(2/17)
FDA (CBER, CDER and CDRH)は、2/17(金)に「Guidance for Industry Providing Regulatory Submissions in Electronic Format — Standardized Study Data」と題したドラフトガイダンスを発行いたしました。 現時点ではまだドラフトガイダンスですが、生物製剤、医薬品および放射線学的健康に関するFDAセンター(CBER、CDERとCDRH)は、標準化電子形式による臨床データの申請を大幅に早める見込みとなるガイダンスをリリースしました。 本テーマに関する一連のガイダンスの一つである本ガイダンスは、人間及び動物の両方の臨床データに対応するすべての施設において、また理解できる申請形式に対する、最初のものです。 本ガイダンスは、他と同様、電子申請の対象について、スポンサーに当局の勧告や期待を伝えるものではなく、申請の技術的側面の詳細に対する仕様及び基準を参照するように役立てるものです。 規制の専門家の特別な関心事は、セクションAにある。標準化された研究データ(4ページ)の計画及び提供については、開発のIND/ IDE段階中に当局に連絡する研究データあるいはデータ管理プランをスポンサーに作成するよう指示するものです。 この計画には、スポンサーの利用目的のデータの基準にしたがった研究計画のリスト及び説明を含める必要があります。 ドラフトガイダンスではまた、臨床データの実装計画の場所、レガシー•データのコンバージョン、管理された専門用語、レビュア・ガイドの使用及びIND一般的な治験計画を提案しています。 さらに、バイオメトリクス•グループに決定的な重要性となるデータのバリデーション及び相互運用性についての広範囲な議論があります。 詳しくはこちら
【新サービス】LIMS導入コンサルテーション
株式会社イーコンプライアンスでは、LIMS(Laboratory Information management System)の導入コンサルテーションを開始いたしました。 2011年1月13日にEU GMP ANNEX 11 Computerised Systemsが改定されました。 ANNEX 11は、FDAのPart11に対する回答書という位置付けで発行されています。 特に、LIMSを用いた出荷判定に関しては、かなり厳しい要件が盛り込まれました。 貴社のLIMSは、ANNEX 11等の最新の規制要件を満たすことができるでしょうか。 またこれからLIMSを導入しようとしている企業では、何を基準にシステムを選定すればいいのでしょうか。 日本製のLIMSのほとんどは最新の規制要件を満たせていません。 イーコンプライアンスでは、どのLIMSを選択すべきか、またバリデーションやPart11対応等の規制要件遵守のためのコンサルテーションをご提供いたします。 詳細はこちら
【無料配布】イーコンプライアンス通信第33号発刊のお知らせ(3/14)
イーコンプライアンスでは、ミニコミ誌「イーコンプライアンス通信」第33号を発刊いたしました。 「イーコンプライアンス通信」では、最新のコンピュータ化システムに関する規制動向や、CSV文書の作成方法、ER/ES指針の解説などを掲載いたします。 ご希望の方には無料でお送りいたします。お申込み、バックナンバーはこちら
システム台帳の整備方法イーラーニング公開のお知らせ(2/17)
2012年1月17日に総評会館で講演致しました。「【無料セミナー】システム台帳の整備方法」をイーラーニングで無料公開いたしました。ぜひ復習にご活用ください。
システム台帳の整備方法(2012年1月17日収録:2:00)
テキストファイルはこちら
第1章 新ガイドライン概要
第2章 新ガイドラインとGMP査察
第3章 システム台帳とは
第4章 システム台帳のスコープ
第5章 システム台帳の整備方法
第6章 既存システムの適格性の確認方法
回顧的バリデーションの実施方法イーラーニング公開のお知らせ(3/9)
2012年2月15日に総評会館で講演致しました。 「【無料セミナー】回顧的バリデーションの実施方法」をイーラーニングで無料公開いたしました。 ぜひ復習にご活用ください。
回顧的バリデーションの実施方法(2012年2月15日収録:2:00)
テキストファイルはこちら
第1章 回顧的バリデーションの概要
第2章 既存システムの適格性の確認方法
第3章 再バリデーションの実施要領
【ビデオ配信】「第22回 CSV研究会」公開のお知らせ(3/22)
2012年2月15日に総評会館で開催いたしました、「第22回 CSV研究会」の模様をイーラーングニ化いたしました。 復習等にご活用ください。
詳細はこちら
「PIC/SのGMPガイドライン活用のための考え方について」発出(2/1)
厚生労働省医薬食品局監視指導・麻薬対策課は、2/1に「PIC/SのGMPガイドライン活用のための考え方について」と題した事務連絡を発出いたしました。
また同時に、質疑応答集(Q&A)および「PIC/SのGMPガイドラインを活用する際の考え方(案)
に関する意見募集の結果について」(パブリックコメントへの回答)も発出いたしました。「PIC/SのGMPガイドラインを活用する際の考え方(案)に関する意見募集について」と題した、パブリックコメントの募集は平成23年11月4日より12月5日までの間募集されていました。
詳しくはこちら
PIC/SのGMPガイドライン活用のためのパブリックコメント募集開始(11/4)
厚生労働省医薬食品局監視指導・麻薬対策課は、11月4日より「PIC/SのGMPガイドラインを活用する際の考え方(案)に関する意見募集について」と題してパブリックコメントの募集を行っています。
締め切りは、12月5日です。
詳しくはこちら
【eCTD書籍セット発売】のお知らせ
2011年11月7日発刊を記念して『eCTD申請 -ここまで身近になったeCTD申請-』と2009年11月30日発刊の『eCTD (基礎から応用まで)- eCTD の解説,実務,医薬品開発における eCTD の現状と課題-』をセットで販売いたします。
セット価格合計30,000円のところ、21,000円(税込)にて特別販売致します。
詳細とご購入はこちら
【新刊発売】eCTD申請 -ここまで身近になったeCTD申請-
2011年11月7日発刊
価格18,000円(税込)
ISBN 978-4-905321-03-3 A4 156頁
詳細とご購入はこちら
【改定版】厚労省ER/ES指針対応実施の手引き発売のお知らせ
2008年に発売した、厚労省ER/ES指針対応実施の手引きの改定版を9/20に発行いたしました。
ISBN 978-4-905321-01-9 A4 90頁 定価12,000円(税込)
詳細はこちら
「最新のCSV動向および21 Part 11も視野に入れたFDA査察対応方法」セミナー(12/8)
~講師が実際に対応したFDA査察事例に学ぶ~
- 価格 :47,250 円(税込)
日時 :2011年12 月8日(木)10:30 ~ 16:30(10:00 開場)
場所 : 東京流通センター(TRC)第4 会議室
講師 :有限会社ソアズ 取締役 杉本 隆之 氏
- 元エーザイ株式会社
- ISPE GAMP Japan Forum リーダー
- 製剤機械技術学会
- トレーサビリティ委員会 委員
詳細とお申込みはこちら
【出版記念講演会】
「eCTD 申請 -ここまで身近になったeCTD 申請-」セミナー(12/7)
価格 :36,750 円(税込)
日時 :2011年12 月7 日(水)10:30 ~ 16:30(10:00 開場)
場所 : 東京流通センター(TRC)第4 会議室
講師 :エーザイ株式会社 比留間 良一 氏
プラネットファーマソリューションズ 深澤 秀通 氏
※特典といたしまして、セミナーにご参加された方全員に新刊本「eCTD 申請 -ここまで身近になったeCTD 申請-」(定価18,000 円)を無料で贈呈いたします。
詳細とお申込みはこちら
コンピュータ化システム適正管理ガイドラインセミナーのお知らせ
来る10/21にTH企画セミナーセンター主催による
「コンピュータ化システム適正管理ガイドライン」の対応
~新ガイドラインの特徴、課題と問題点、準備作業について~
と題したセミナーをイーコンプライアンス 代表取締役 村山 浩一が担当いたします。 詳しくはこちら
新刊発売のお知らせ
2008年に発売開始した、GAMP 5, FDA, ANNEX 11 に対応した「コンピュータバリデーション実施の手引き」の改定版を発行いたしました。
ISBN 978-4-905321-00-2 A4 132頁 定価12,000円(税込)
好評発売中!
詳細はこちら
【ビデオ配信】「厚労省新ガイドラインに適合したCSVの実施方法」セミナー(7/22)
2011年7月11日に総評会館で開催いたしました、「厚労省新ガイドラインに適合したCSVの実施方法」のセミナーの模様をイーラーニング化いたしました。
無料でご視聴いただけます、復習等にご活用ください。
「厚労省新ガイドラインに適合したCSVの実施方法」
テキストPDFファイルはこちら
【収録内容】
第1章 新ガイドラインとGMP査察
第2章 GMPとバリデーション
第3章 適格性評価とは
第4章 新ガイドライン概要
第5章 PIC/Sと新ガイドライン
第6章 新ガイドライン対応の優先順位
第7章 QCラボにおける新ガイドライン対応
第8章 LIMSと出荷判定
コンサルティングアシスタント採用のお知らせ
株式会社イーコンプライアンスでは、業務拡大に伴い、新規スタッフを募集しています。
コンサルタントに同行し、ITに関する知識を使ってお客様先で打合せを行います。英語が堪能な方は、外資系企業を担当してTV会議参加や海外出張などグローバルに活躍して頂きます。
オフィスでは、コンサルティングに必要な資料等の作成をお願いします。
詳しくはこちらからお問合せ下さい。
セミナーのお知らせ
【株式会社プロス主催】CSV新ガイドライン対応リスクアセスメント実践セミナー
株式会社プロスでは、2011年6月17日(金)~2011年9月30日(金)まで
製造、品質、システム 各部門の責任者および担当者を対象にした「CSV新ガイドライン対応リスクアセスメント実践セミナー」を開催しております。
ぜひご参加ください。詳細はこちら
RxLogix社との業務提携
株式会社イーコンプライアンスとRxLogix社(本社:カリフォルニア州、Raj More社長)は、業務提携することで合意しました。
RxLogix社は、グローバル安全性情報管理(Pharmacovigilance:PV)業務に造詣が深く、ORACLE社が全世界的に販売しているArgus Safetyシステムを中心に、システム構築、ビジネスプロセス構築等の支援をしています。
これまで海外の安全性情報管理システムは、日本当局の要件を完全にサポートしていませんでした。そのため、日本独自のシステムを導入せざるを得ませんでした。
また日本を含めたグローバルの安全性情報管理に関するコンサルテーションを実施できるコンサルティングチームも希少でした。
しかしながら、今後はArgusシステムを導入し、当社およびRxLogix社のコンサルティングを採用いただくことによって、グローバルに真のSingle Safety Databaseの構築が行えます。
株式会社イーコンプライアンスは、日本におけるパートナーとして、現行システムからのデータ移行も含めて、グローバル安全性情報管理システム構築のご支援を行います。
English
FDAがガイドライン ドラフト版を発行
FDAは、2011年1月6日「Electronic Source Documentation in Clinical Investigations」(ドラフト)を発行いたしました。
パブリックコメントの募集が90日間行われています。
詳しくはこちら
翻訳はこちらをご参照ください。
ANNEX 11改定版発行(1/13)
ECA(Eupopean Compliance Agency)は、2011年1月13日「ANNEX 11 Computerised Systems」の改定版を発行いたしました。
詳しくはこちら
対応期限は、2011年6月30日となりました。
日本語訳はこちら
新刊発売のお知らせ(12/8)
【厚労省新ガイドライン対応シリーズ①】
医薬品・医薬部外品製造販売業者における「コンピュータ化システム適正管理ガイドライン」対応準備の手引き~適用日までに何を準備しなければならないか~
詳しくはこちら
A4版 定価¥12,000-(税込)
ISBN:978-4-904512-08-1
本書籍は、電子ファイル(pdf)でも販売しております。
ただし、ご購入はクレジットカード払いに限ります。
商品のダウンロードは、こちらからお願いします。
厚労省新ガイドライン発出(10/21)
厚生労働省は、2010年10月21日「医薬品・医薬部外品製造販売業者等におけるコンピュータ化システム適正管理ガイドライン」を発出しました。
適用開始は、平成24年4月1日からとなりました。詳しくはこちら
同時に、事務連絡として質疑応答集(Q & A)も発行されました。詳しくはこちら
本ガイドラインは、2010年7月16日に案が発表され、同8月20日までパブリックコメントが募集されました。パブリックコメントは、31通394件寄せられたとのことです。
なおパブリックコメントの回答は、ここで参照できます。
また、同ガイドライン(案)からの変更点については、こちらをご参照ください。
株式会社イーコンプレス設立のお知らせ
2010年9月16日にセミナー、書籍等の企画・販売専門会社として株式会社イーコンプレスを設立いたしました。
これまでイーコンプライアンスで販売をしておりましたセミナー、書籍等はイーコンプレスのホームページでご案内いたします。
詳しくはこちらをご覧ください。
書籍販売提携に関するお知らせ(8/1)
株式会社イーコンプライアンスとサイエンス&テクノロジー株式会社(東京都港区浜松町2-7-14 福嶋 邦彦社長)は、株式会社イーコンプライアンスがS&T社が主催するセミナーの一部販売に加えて、S&T社が発行する書籍の一部を販売することで業務提携することに合意いたしました。
株式会社イーコンプライアンスのホームページからお申込み頂け、クレジットカード払い、コンビニ決済、Edy、銀行振込などの各種決済方法をお選びいただけます。
会員の方にはポイントを差し上げます。また貯まったポイントを次回以降のお買い物にご利用いただけます。
FDAがPart11査察開始を宣言(7/8)
2010年7月8日、FDAは21 CFR Part 11の査察開始(再開)をアナウンスしました。
詳しくはこちら
翻訳は、こちらをご参照ください。
FDAのPart11査察に関する考え方は、こちらをご参照ください。